
| A. | 蒸发皿 | B. | 长颈漏斗 | C. | 烧杯 | D. | 玻璃棒 |
科目:高中化学 来源: 题型:解答题
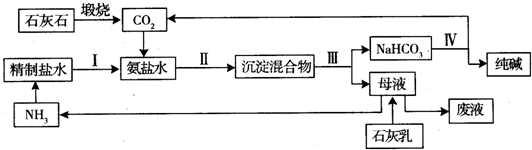
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过年时尽量少燃放烟花爆竹 | |
| B. | PM2.5是形成沙尘暴天气的主要因素 | |
| C. | 其颗粒小,在大气中的停留时间长、输送距离远,因而对人体健康影响更大 | |
| D. | 香烟烟雾颗粒的直径大多在0.1至1.0微米,所以公共场所禁烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 滴定管装滴定液前应先用该溶液润洗 | |
| C. | 分液漏斗和蒸馏烧瓶使用前都要检查是否漏液 | |
| D. | 配制溶液时,只要容量瓶的容积符合要求就可以直接使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
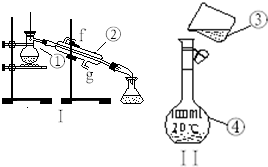 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图Ⅰ为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图Ⅰ为两套实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com