
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
分析 恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡,据此概念可知,只要满足二氧化硫与氧气的投料比为2:1即可.
解答 解:恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡,据此概念可知,只要满足二氧化硫与氧气的投料比为2:即可;
A.a=2,b=1,符合二氧化硫与氧气的物质的量之比为2:1,c可以为任意值,故A正确;
B.a=1,b=1,不符合二氧化硫与氧气的物质的量之比为2:1,故B与题给条件不是等效平衡,故B错误;
C.a=1,b=0,不符合二氧化硫与氧气的物质的量之比为2:1,故C与题给条件不是等效平衡,故C错误;
D.a=0,b=1,不符合二氧化硫与氧气的物质的量之比为2:1,故D与题给条件不是等效平衡,故D错误,
故选A.
点评 本题考查化学平衡计算、等效平衡等,难度中等,理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比;2、恒温恒压,按化学计量数转化一边,对应物质满足等比.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
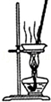 | 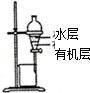 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
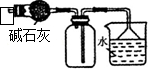 | 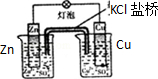 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
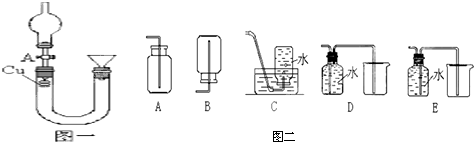

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
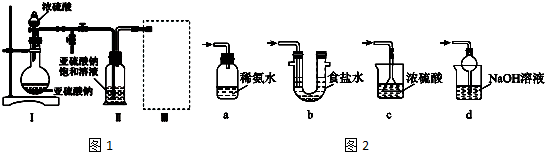

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN易溶于水 | |
| B. | 1mol/L氢氰酸溶液的pH约为3 | |
| C. | 10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | HCN溶液的导电性比盐酸溶液的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com