
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取氯化钠、溴、碘不一定都要通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用高纯度的硅来制备光导纤维 |
分析 A.根据造成雾霾天气的原因判断;
B.海水中提取氯化钠为物理变化,提取溴、碘为化学变化;
C.燃料脱硫可以减少二氧化硫的排放,减少汽车尾气的排放可以减少含氮气体的排放;
D.光导纤维的主要成分为二氧化硅.
解答 解:A.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故A正确;
B.从海水中提取氯化钠为物理变化,提取溴、碘需要通过化学反应才能实现,故B正确;
C.酸雨形成的主要原因是燃料燃烧生成的二氧化硫或者氮的氧化物形成硫酸或者硝酸形成的,将燃料脱硫和减少汽车尾气排放都可减少酸雨的产生,故C正确;
D.用高纯度的硅来制备的是半导体材料,光导纤维的主要成分为二氧化硅,故D错误;
故选D.
点评 本题考查了常见生活环境的污染与治理、海水的利用等问题,为高频考点,题目难度不大,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期系中ⅠA族元素又称为碱金属元素 | |
| B. | 元素周期系中每一周期元素的种类均相等 | |
| C. | 元素周期系的形成原因是核外电子排布的周期性变化 | |
| D. | 每一周期的元素最外层电子数均是1→8,周而复始 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
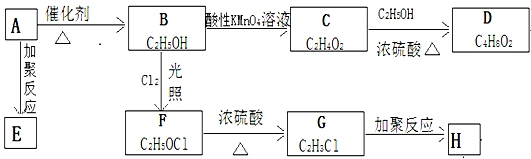
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧产物只有CO2和H2O | B. | 与溴水发生取代反应 | ||
| C. | 都难溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
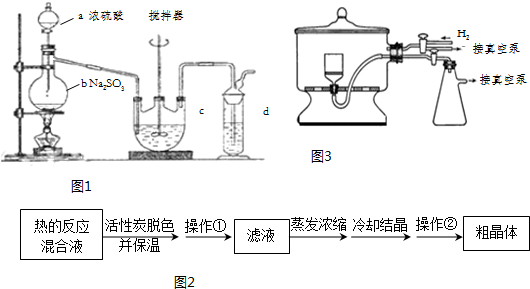
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com