
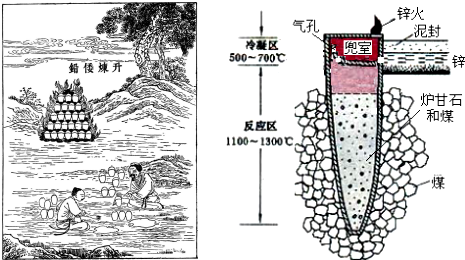
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
分析 “升炼倭铅”的反应:ZnCO3$\frac{\underline{\;500℃\;}}{\;}$CO2↑+ZnO、CO2+C$\frac{\underline{\;>900℃\;}}{\;}$2CO、ZnO+CO$\frac{\underline{\;>907℃\;}}{\;}$Zn(g)+CO2,
A.由一种物质生成两种或多种物质的反应是分解反应,有电子转移的反应是氧化还原反应;
B.反应区温度达到1100~1300℃,Zn变为蒸气与杂质分离,在“兜室”冷凝为液体;
C.Zn易被空气氧化;
D.CO是可燃性气体,易燃烧.
解答 解:“升炼倭铅”的反应:ZnCO3$\frac{\underline{\;500℃\;}}{\;}$CO2↑+ZnO、CO2+C$\frac{\underline{\;>900℃\;}}{\;}$2CO、ZnO+CO$\frac{\underline{\;>907℃\;}}{\;}$Zn(g)+CO2,
A.由一种物质生成两种或多种物质的反应是分解反应,有电子转移的反应是氧化还原反应,根据以上分析知,ZnCO3$\frac{\underline{\;500℃\;}}{\;}$CO2↑+ZnO为分解反应,CO2+C$\frac{\underline{\;>900℃\;}}{\;}$2CO、ZnO+CO$\frac{\underline{\;>907℃\;}}{\;}$Zn(g)+CO2为氧化还原反应,故A正确;
B.反应区温度达到1100~1300℃,Zn变为蒸气与杂质分离,在“兜室”冷凝为液体流出(冷凝区温度高于Zn的熔点),故B错误;
C.Zn易被空气氧化,为防止Zn被氧化而用“泥封”隔绝空气,故C正确;
D.“锌火”是未反应完的CO和Zn蒸气从“兜室”逸出燃烧,故D正确;
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断及获取信息分析问题能力,知道图中发生的反应是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
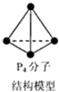
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )| A. | 未滴加NaOH溶液时溶液的pH小于相同条件下0.1mol•L-1 NaHSO4溶液的pH | |
| B. | pH为7时混合溶液中水的电离程度最大 | |
| C. | 当V(NaOH)=30mL时,c(NH3•H2O)+c(Na+)<2c(SO42-) | |
| D. | 滴加NaOH溶液的体积从30mL至40mL的过程中,$\frac{c(N{{H}_{4}}^{+})}{c({H}^{+})}$的值逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
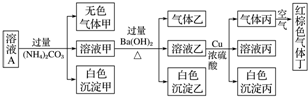
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 在细菌作用下铜矿石可以直接转换为单质铜.这个过程叫作生物炼铜 | |
| D. | 天津港爆炸事件中参与燃烧的一种危险品“甲苯二异氰酸酯(TDI)”,该危险品属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
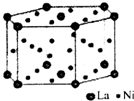 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据lmolO2和Mg完全反应获得4mol电子;可推出lmo1 O2和其他金属完全反应都获得4mol电子 | |
| B. | 相同pH值的H3PO4和H2SO4溶液,稀释相同倍数再分别测其pH值,若H3PO4溶液的pH小于H2SO4溶液,可推出元素的非金属性S>P | |
| C. | 根据Cl2+2KI=2KCl+I2反应中,氧化性:Cl2>I2;可推出SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,氧化性:C>Si | |
| D. | 向3%H2O2溶液中加0.1gMnO2粉末比加2滴1mol•L-1FeCl3溶液反应剧烈;根据此实验可推出MnO2的催化效果一定比FeCl3好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
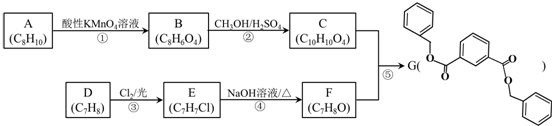
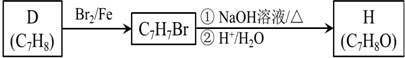
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
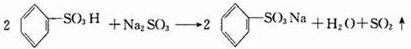 、③
、③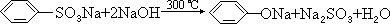 、④
、④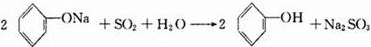 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com