
【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。
【答案】硫酸 PbO+C![]() Pb+CO↑ Pb2++2e-===Pb Cu、Ag PbCl2难溶,覆盖在铅表面,阻止反应进行 ClO-+PbO===PbO2+Cl- 假设能发生如下反应:Pb2++H2S===PbS↓+2H+,该反应的平衡常数
Pb+CO↑ Pb2++2e-===Pb Cu、Ag PbCl2难溶,覆盖在铅表面,阻止反应进行 ClO-+PbO===PbO2+Cl- 假设能发生如下反应:Pb2++H2S===PbS↓+2H+,该反应的平衡常数![]() ,反应进行完全,故有黑色沉淀 沉淀溶解,得橙色溶液 2PbCrO4+2H+===2Pb2++Cr2O72-+H2O
,反应进行完全,故有黑色沉淀 沉淀溶解,得橙色溶液 2PbCrO4+2H+===2Pb2++Cr2O72-+H2O
【解析】
(1)PbS在焙烧过程中生成PbO和SO2等,SO2用于工业上制备硫酸的原料;
(2)根据步骤,高温还原步骤中加入焦炭,将PbO还原成Pb,发生的主要方程式为PbO+C![]() Pb+CO↑;
Pb+CO↑;
(3)精炼时,粗铅作阳极,纯铅作阴极,含有Pb2+溶液为电解质溶液,因此阴极反应式为Pb2++2e-=Pb;阳极泥的主要成分是Cu和Ag;
(4)根据Ksp得出PbCl2为难溶水的物质,当Pb与HCl反应时生成难溶于水的PbCl2,PbCl2附着在Pb的表面阻碍反应的进行;PbO中Pb的化合价由+2价→+4价,化合价升高,即NaClO作氧化剂,ClO-被还原成Cl-,制备PbO2的离子方程式为PbO+ClO-=PbO2+Cl-;
(5)向Pb(NO3)2溶液中通入H2S气体生成PbS沉淀,发生反应的离子方程式是Pb2++H2S=PbS+2H+,该反应的平衡常数K=![]() =1.0×107>105,反应进行完全,因此有黑色沉淀;
=1.0×107>105,反应进行完全,因此有黑色沉淀;
(6)CrO42-溶液存在:2CrO42-+2H+![]() Cr2O72-+H2O,加入硝酸,增加c(H+),平衡向正反应方向移动,PbCrO4加入足量的硝酸中发生离子反应2PbCrO4+2H+=2Pb2++Cr2O72-+H2O,沉淀溶解,溶液的颜色变为橙色。
Cr2O72-+H2O,加入硝酸,增加c(H+),平衡向正反应方向移动,PbCrO4加入足量的硝酸中发生离子反应2PbCrO4+2H+=2Pb2++Cr2O72-+H2O,沉淀溶解,溶液的颜色变为橙色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
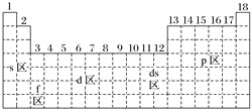
A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________,能量最高能级的电子云形状为_________。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________,写出一个与SCN-具有相同空间构型的分子:_________。
(3)氮元素的最简单氢化物为氨,氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一种氢化物联氨(N2H4)是_________(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0]丁烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与1,3-丁二烯互为同分异构体
B. 二氯代物共有4种
C. 碳碳键只有单键且彼此之间的夹角有45°和90°两种
D. 每一个碳原子均处于与其直接相连的原子构成的四面体内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增大反应物浓度,反应的ΔH也随之改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com