
【题目】短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,下列关系正确的是( )
都具有相同的电子层结构,下列关系正确的是( )
A.离子的还原性:![]() ,质子数:
,质子数:![]()
B.氢化物的稳定性:![]()
C.第一电离能:![]() ,原子半径:
,原子半径:![]()
D.电负性:![]()
【答案】D
【解析】
元素周期表前三周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 具有相同电子层结构,核外电子数相等,所以
具有相同电子层结构,核外电子数相等,所以![]() ,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素。
,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素。
A.由以上分析可知![]() ,
,![]() ,则质子数
,则质子数![]() ,非金属性
,非金属性![]() ,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性
,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性![]() ,故A错误;
,故A错误;
B.非金属性![]() ,非金属性越强氢化物越稳定性,氢化物稳定性为
,非金属性越强氢化物越稳定性,氢化物稳定性为![]() ,故B错误;
,故B错误;
C.W为Al元素,X为Na元素,同周期随原子序数增大原子半径减小、第一电离能呈增大趋势,故原子半径![]() ,第一电离能
,第一电离能![]() ,故C错误;
,故C错误;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:![]() ,故D正确;
,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素或者化合物性质的比较中,正确的是![]()
![]()
A. 结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以![]()
B. Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C. 在分子中,两个原子间的键长越长,键能越大
D. 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钡氧化物二次电池。电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 该电池充电时,锂极与外电源的负极相连
B. 该电池放电时,Li+向负极移动
C. 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D. 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法不正确的( )

A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应物浓度减小引起的
D.图中阴影“面积”可以表示t1-t2时间内c(ClO3-)的减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物同分异构体说法中错误的是
A. 三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
B. 立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有3种
)经硝化可得到六硝基立方烷,其可能的结构有3种
C. β-月桂烯(![]() )与溴发生1:1加成反应,产物(只考虑位置异构)有3种
)与溴发生1:1加成反应,产物(只考虑位置异构)有3种
D. 酯类化合物C4H8O2在酸性条件下水解得到的醇可能有4种不同结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
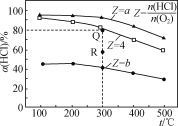
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
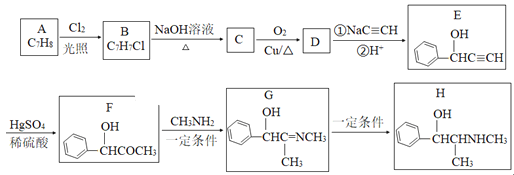
【题目】有机物H是一种中枢神经兴奋剂,其合成路线如图所示。
请回答下列题:
(1)A的化学名称为___,C的结构简式为___。
(2)E中官能团的名称为___。B→C、G→H的反应类型分别为___、__。
(3)D分子中最多有___个原子共平面。
(4)写出C→D反应的化学方程式为___。
(5)同时满足下列条件的E的同分异构体有___种(不考虑立体异构)。
①与E具有相同官能团;②苯环上有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式正确的是________。
A.H2(g)+![]() O2(g)═H2O(g)△H=+285.8kJ/mol
O2(g)═H2O(g)△H=+285.8kJ/mol
B. H2(g)+![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
C. H2(g)+![]() O2(g)═H2O(l)△H=+285.8kJ/mol
O2(g)═H2O(l)△H=+285.8kJ/mol
D. H2+![]() O2═H2O△H=﹣285.8 kJ/mol
O2═H2O△H=﹣285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是______(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)2NH3(g) △H=﹣92.4 kJ/mol
反应达到平衡后,升高温度则反应速率_______(填“增大”或“减小”);平衡将向____________(填“正反应方向”或“逆反应方向”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com