

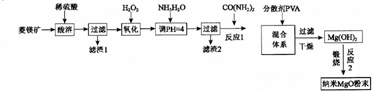
 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).分析 重晶石和煤粉碎后煅烧粉碎反应生成硫化钡、二氧化碳,尾气主要是一氧化碳,反应后的固体浸取后通入二氧化碳预碳化,加入硫氢化钡溶液反应生成碳酸钡沉淀和硫化氢气体,碳酸钡脱硫后过滤干燥得到碳酸钡产品,
(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,氧化产物为二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,当温度过高时,尾气中有毒气体的含量会升高是高温下碳和二氧化碳反应生成有毒气体一氧化碳;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
(3)碳化时Ba(HS)2和二氧化碳气体发生反应生成碳酸钡沉淀和硫化氢气体;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中存在电荷守恒;
(6)钡餐的主要成分是硫酸钡,硫酸钡难电离,在溶液中不能电离出有毒的钡离子,不会使人体中毒;碳酸钡能与稀盐酸反应生成可溶性的氯化钡,氯化钡能电离出有毒钡离子.
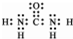
解答 解:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为: ,
,
故答案为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑; ;
;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施,
故答案为:升温或搅拌;
(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑,
故答案为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$=$\frac{1.6×1{0}^{-5}}{2.5×1{0}^{-9}}$=6.4×103,
故答案为:6.4×103;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS-)+c(OH-)+2c(S2-),
故答案为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);2c(Ba2+)+c(H+)=c(HS-)+c(OH-)+2c(S2-);
(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒,
故答案为:BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒.
点评 本题考查了物质制备工艺流程分析,主要是程度溶解平衡常数计算、电解质溶液中离子浓度大小比较、电荷守恒等知识点,掌握基础是解题关键,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

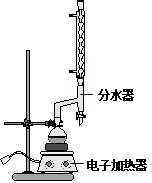
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
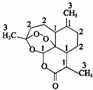 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
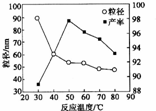
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
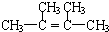 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com