
����Ŀ��A��B��C��D��E�Ǹ��н�ѧϰ�ij������ʻ����������A�ڳ����¿��Ժ��������ɻ�����C,��A���Ժ�����������Һ��Ӧ��������E����ɫ���ʣ������ں�����ߣ�����һ�ֻ��ý���D��������ȼ�յõ�������B������Ԫ���ڵؿ��к������ڵ��ġ��ش����⣺
��1������E�Ļ�ѧʽ___________��E��ˮ��Ӧ�����ӷ���ʽ____________________��
��2������A��NaOH��Ӧ�����ӷ���ʽ_______________________��������C�����ᷴӦ�����ӷ���ʽ��_______________________________��
��3������B��ˮ������Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��4������D��CuSO4��Һ��Ӧ�Ļ�ѧ����ʽΪ__________________________��
��5�����ý���D��ˮ�ķ�Ӧ�У���___________�������������ԭ��������
���𰸡� Na2O2 2Na2O2+2H2O��4Na��+4OH��+O2�� 2Al+2OH-+2H2O=2AlO2-+3H2�� Al2O3+6H+=2Al3++3H2O 3Fe+4H2O(g)![]() Fe3O4+4H2 2Na+2H2O=2NaOH+H2����2NaOH+CuSO4=Cu(OH)2��+Na2SO4����2Na+2H2O+CuSO4=Cu(OH)2��+Na2SO4 +H2�� ��ԭ��
Fe3O4+4H2 2Na+2H2O=2NaOH+H2����2NaOH+CuSO4=Cu(OH)2��+Na2SO4����2Na+2H2O+CuSO4=Cu(OH)2��+Na2SO4 +H2�� ��ԭ��
��������A��B��C��D��E�Ǹ��н�ѧϰ�ij������ʻ����������A�ڳ����¿��Ժ��������ɻ�����C����A���Ժ�����������Һ��Ӧ�����A������C����������������E����ɫ���ʣ������ں�����ߣ�����һ�ֻ��ý���D��������ȼ�յõ�����D���ƣ�E�ǹ������ơ�����B������Ԫ���ڵؿ��к������ڵ�������B��������1������E�Ļ�ѧʽΪNa2O2����ˮ��Ӧ�����ӷ���ʽΪ2Na2O2+2H2O��4Na��+4OH��+O2������2����������NaOH��Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2���������������������ᷴӦ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O����3����������ˮ������Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O(g)![]() Fe3O4+4H2����4����������CuSO4��Һ��Ӧ������������������ͭ����������Ӧ�Ļ�ѧ����ʽΪ2Na+2H2O+CuSO4=Cu(OH)2��+Na2SO4 +H2������5�����ý�������ˮ�ķ�Ӧ������������������������Ԫ�ػ��ϼ�������ʧȥ����������ԭ����
Fe3O4+4H2����4����������CuSO4��Һ��Ӧ������������������ͭ����������Ӧ�Ļ�ѧ����ʽΪ2Na+2H2O+CuSO4=Cu(OH)2��+Na2SO4 +H2������5�����ý�������ˮ�ķ�Ӧ������������������������Ԫ�ػ��ϼ�������ʧȥ����������ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ����������ԭ��Ӧ��2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2��SO4��3+K2SO4+8H2O�������ԭ��أ�������װ�б�����Һ������˵����ȷ���ǣ� �� 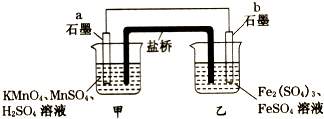
A.a�缫�Ϸ����ķ�ӦΪ��MnO4��+8H++5e���TMn2++4H2O
B.���·���ӵ������Ǵ�a��b
C.��ع���ʱ�������е�SO42��������ձ�
D.b�缫�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ѧѧ��������ѧ�桷2014���2�ڵ����¡�ŷ����ͣ���պ���̼�ŷ�˰�ķ���˼�����������´�ŷ����ͣ���պ���̼�ŷ�˰�ı������֣�������ŷ�����պ���̼�ŷ�˰�����齹�����ڣ�����ŷ����ͣ���պ���̼�ŷ�˰��������������������պ���̼�ŷ�˰��δ�����ƵĹ۵㣬ϣ���ڷ������л�һ���ӽ����������պ���̼�ŷ�˰���ڻ����������������º��ʷ��Ĵٽ����ã�
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��
C+KMnO4+H2SO4=CO2��+MnSO4+K2SO4+H2O
��2����2L�ܱ������м���NO�ͻ���̿�������ʣ�����������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ��������
n/mol | ����̿ | NO | E | F |
��ʼ | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
������ӦT1��ʱ��ƽ�ⳣ��ΪK1 �� T2��ʱ��ƽ�ⳣ��ΪK2 ��
�ټ��㣺K1=
�ڸ���������Ϣ�жϣ��¶�T1��T2�Ĺ�ϵ�ǣ�����ţ� ��
A�� T1��T2 B�� T1��T2 C�����Ƚ�
��3����ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������CO��g��+H2O��g��CO2��g��+H2��g������H=��41kJ/mol
��֪��2H2O ��g���T2H2��g��+O2��g������H=+484kJ/mol��
��д��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
��ij�¶��£���һ�ݻ��ɱ�������У�COת������CO2�ķ�Ӧ�ﵽƽ��ʱ��CO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬��ƽ�����������ߵ����ʵ��������µ�������ʹƽ�����Ƶ��ǣ�������ţ� ��
A�� ������1mol B�� ���ӱ� C�� ������1mol D�� �����룮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�������ǣ� ��
A.��������ֱ����1��100nm֮��
B.�������Ӵ����
C.�������Ӳ��ܴ�����Ĥ
D.���������ܹ����������˶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Һ�������ʱ��һ�������仯����
A.�����ڻ�ѧ��B.���ۼ�����
C.���ӵĹ���D.���Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��װ��������֤NaHCO3���ȶ��ԣ�����������ʵ�顣DΪ�̶������ӲֽƬ���Իش��������⣺
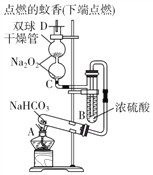
��1����A�Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ��_________________________��
��2����˫�������ڷ�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��˫�������ڹ۲쵽��ʵ��������_________________________��ͨ�������ʵ������ijͬѧ�ܵ���������ͼ��ʾװ����ȡ�������������Իش��������⣺
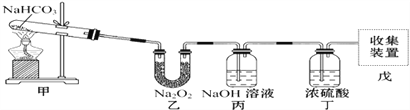
��4������NaOH��Һ��������______________������Ũ�����������____________��
��5������ԭװ������˳���Ϊ�ס������ҡ������죬����װ�������ܷ��ռ���������____����ܡ����ܡ�����ԭ����___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѷ���Ҫ��Ļ�ѧ����ʽ����ĸ�������пհ״���
A����NH4��2SO3 ![]() 2NH3��+H2O+SO2��
2NH3��+H2O+SO2��
B��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O
C��2C+SiO2 ![]() Si+2CO��
Si+2CO��
D��NH4NO3 ![]() N2O��+2H2O
N2O��+2H2O
E��Na2CO3+CO2+H2O�T2NaHCO3
F��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�ټ����ڷֽⷴӦ����������ԭ��Ӧ����
�����ڷֽⷴӦ��������������ԭ��Ӧ����
�����ڻ��Ϸ�Ӧ��������������ԭ��Ӧ����
�ܲ��������ֻ�����Ӧ���͵�������ԭ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������������Ȼ��г�ദ����
A.�ܶ���жԷϾɵ�ؽ��л��մ���
B.������ҶԷϾ���������������������
C.���ڲ��ٵ�������ʹ��������̫���ܡ����ܵ���Դ�����ͳ��ú̿
D.����ط�������̨��ط����������������ֶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1����֪ʵ�����Ʊ���������ͨ�����ȸ������ʵ�֣��䷢���ķ�Ӧ���£�2KMnO4 ![]() K2MnO4+MnO2+O2�����б�������Ԫ���� �� ��ԭ������ ��
K2MnO4+MnO2+O2�����б�������Ԫ���� �� ��ԭ������ ��
��2���������Ͽ�֪��ͭ��ŨH2SO4���ȣ��������·�Ӧ��Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ �� ����H2SO4�ڷ�Ӧ�������ԣ�
CuSO4+SO2��+2H2O�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ �� ����H2SO4�ڷ�Ӧ�������ԣ�
��3����һ�������£�RO3n���ͷ����ɷ������·�Ӧ��RO3n��+F2+2OH��=RO4��+2F��+H2O�Ӷ���֪��RO3n����Ԫ��R�Ļ��ϼ��� ��
��4������˫���ű�ʾ���з�Ӧ����ʽ��ת�Ƶĵ�����Ŀ������
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2��+7H2O
����Ӧ�У�����������Ӧ��HClΪ1.2mol����ԭ��K2Cr2O7���ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com