
【题目】洗涤盛过植物油的试管,宜选用的试剂是( )
A. 稀盐酸 B. 热水
C. 热碱液 D. 稀硝酸
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________________。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。

①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
②b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
③反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化 B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化 D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
②Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________________________。
(4)某工业废水中含有Hg2+、Cu2+等离子。取一定量的该工业废水,向其中投入一定量的MnS固体,当CuS开始沉淀时,溶液中![]() =____________(结果保留两位有效数字)。
=____________(结果保留两位有效数字)。
[已知:Ksp(HgS)=6.4×1053,Ksp(CuS)=1.3×1036,Ksp(MnS)=2.5×1013。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中生小张正处于身体发育的快速增长期, 但其经常感觉到腿抽筋并有严重蛀牙, 他可能需要补充无机盐
A. Na+ B. Ca2+ C. Mg2+ D. Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
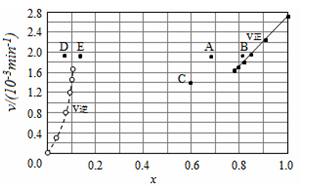
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收利用。生活中废弃的塑料袋、医院的废输液管、废旧轮胎等可以归为一类加以回收利用。它们属于( )
A.无机物B.有机物C.氧化物D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是 ( )
①a=b-2;②a+b=8;③a+b=30;④a=b+8
A. ①②③④ B. ②③④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO47H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO47H2O易溶于水,难溶于乙醇。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中滴入酸性KMnO4溶液可发生如下反应,完成该反应的离子方程式:____Fe2++___AsO33-+___MnO4-+___□=___Mn2++___FeAsO4↓+___□,
_________________________,判断该滴定终点的现象是_____________________________________。
(3)流程中②调节pH时可以选用的试剂为__________,滤渣Ⅱ的主要成份为________。
(4)制得的ZnSO47H2O需洗涤,洗涤晶体时可选用试剂为(________)。
A.水 B.乙醇 C. 饱和硫酸锌溶液 D.稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种溶液中:①pH值为0的盐酸;②0.lmol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为
A. 0:1: 12:11 B. 14:13:12:11
C. 14:13:2:3 D. 1:10:100:1000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 用浓溴水除去苯中的苯酚
B. 用核磁共振氢谱鉴别1—丙醇和2—丙醇
C. 不慎将苯酚溶液沾到皮肤上,立即用稀NaOH溶液清洗
D. 苯与酸性KMnO4溶液混合振荡、静置分层,下层液体为无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com