
| ||
| ||


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、4:3 | B、5:4 |
| C、4:5 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 氧化铁 Fe3O4 |
| B、酸性氧化物 碳酸气 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| B、用10ml的量筒量取5.2ml的盐酸 |
| C、用托盘天平称取25.2gNaCl |
| D、用50ml容量瓶配制100ml 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 混合溶液 | A | B | C | D | E | F |
| 等浓度的稀草酸溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
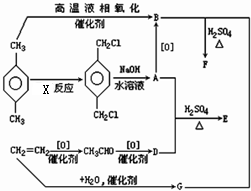 有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:
有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:查看答案和解析>>
科目:高中化学 来源: 题型:
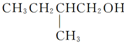 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com