
科目:高中化学 来源: 题型:选择题
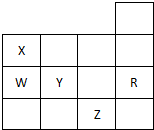
| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
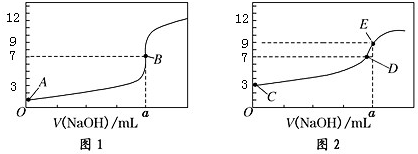
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com