
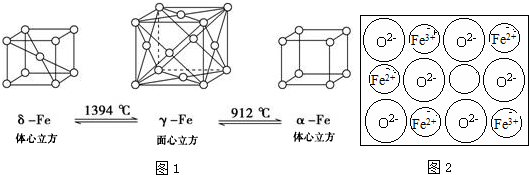
 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.分析 (1)Fe是26号元素,根据核外电子排布规律书写铁原子基态电子排布式;
(2)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,据此判断;
(3)SCN-表示中,碳原子都处于中央,碳周围有两个δ键,没有孤电子对,所以碳原子按sp方式杂化,互为等电子体的粒子结构相似,所以根据二氧化碳的结构可判断异硫氰根离子的电子式,FeCl3与KSCN在水溶液按1:5反应,根据元素守恒写出化学方程式;
(4)A.根据γ-Fe晶胞结构图判断;
B.δ-Fe晶体和α-Fe晶体都是非密置在三维空间堆积而成的,堆积方式不同,堆积后非密置层的结构会发生变化不变;
C.γ-Fe晶体、δ-Fe晶体和α-Fe晶体中,分别为面心立方最密堆积、简单立方积堆、面心立方堆积,铁原子的配位数为12、8、6,所以三种晶体的空间利用率分别为74%、68%、52%,据此判断;
D.设铁原子半径为a,根据晶胞结构图,γ-Fe晶体中晶胞的棱长为$\frac{4a}{\sqrt{3}}$,δ-Fe晶体中晶胞的棱长为$\frac{4a}{\sqrt{2}}$,α-Fe晶体中晶胞的棱长为2a,据此判断;
(5)FexO有NaCl结构的晶胞,则每个晶胞中有4个FexO,根据$ρ=\frac{4×(56x+16)}{{N}_{A}•{a}^{3}}$可计算得x的值.
解答 解:(1)Fe是26号元素,根据核外电子排布规律可知铁原子基态电子排布式为[Ar]3d64s2,故答案为:[Ar]3d64s2;
(2)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满状态,是一种较稳定的结构,所以Fe3+比Fe2+稳定,
故答案为:Fe3+;Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满状态,是一种较稳定的结构;
(3)SCN-表示中,碳原子都处于中央,碳周围有两个δ键,没有孤电子对,所以碳原子按sp方式杂化,互为等电子体的粒子结构相似,所以根据二氧化碳的结构可判断异硫氰根离子的电子式为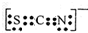 ,FeCl3与KSCN在水溶液按1:5反应,反应的化学方程式为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl,
,FeCl3与KSCN在水溶液按1:5反应,反应的化学方程式为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl,
故答案为:sp;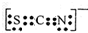 ;FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
;FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
(4)A.根据γ-Fe晶胞结构图,以顶点铁原子为例,每个铁原子周围距离最近的铁原子分布在经过该顶点的12个面的面心上,所以铁的配位数为12,故A正确;
B.δ-Fe晶体和α-Fe晶体都是非密置在三维空间堆积而成的,堆积方式不同,堆积后非密置层的结构会发生变化不变,故B错误;
C.γ-Fe晶体、δ-Fe晶体和α-Fe晶体中,分别为面心立方最密堆积、简单立方积堆、面心立方堆积,铁原子的配位数为12、8、6,所以三种晶体的空间利用率分别为74%、68%、52%,故C正确;
D.设铁原子半径为a,根据晶胞结构图,γ-Fe晶体中晶胞的棱长为$\frac{4a}{\sqrt{3}}$,δ-Fe晶体中晶胞的棱长为$\frac{4a}{\sqrt{2}}$,α-Fe晶体中晶胞的棱长为2a,所以三种晶胞的棱长之比为:2$\sqrt{3}$:3$\sqrt{2}$:3,故D正确;
故选B;
(5)FexO有NaCl结构的晶胞,则每个晶胞中有4个FexO,晶胞的密度为5.71g•cm-3,晶胞棱长为a=4.28×10-8cm,根据$ρ=\frac{4×(56x+16)}{{N}_{A}•{a}^{3}}$可得,x=0.92,
故答案为:0.92.
点评 本题主要考查了核外电子排布、电子式、配合物、晶体结构、晶胞的计算等知识,综合性比较强,难度较大,答题时注意晶胞结构的观察和判断.


科目:高中化学 来源: 题型:解答题
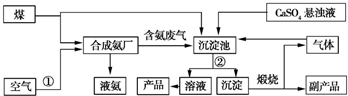
 2NH3.
2NH3. CaCO3↓+(NH4)2SO4.
CaCO3↓+(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
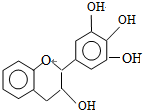
| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
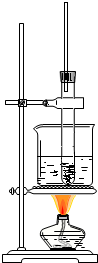 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com