
1×10-5mol·L-1的盐酸溶液稀释1000倍后,该盐酸溶液的pH值为?
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
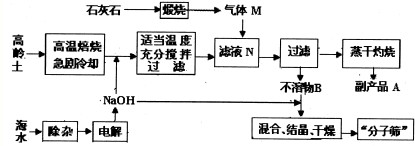
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?肇庆二模)请回答有关锌及其化合物的问题.
(2011?肇庆二模)请回答有关锌及其化合物的问题. Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 饮用矿物质水 净含量:500mL 配料表:纯净水 硫酸镁 氯化钾 保质期:12个月 主要离子成份:钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子( Cl-):10~27.3mg/L 硫酸根离子(SO42-):0.4~19.2mg/L 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |