
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
分析 根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,以此解答该题.
解答 解:A.原电池中两个不同的电极,所以正负极不能都是Fe,故A错误.
B.铁的活泼性大于Ag,铁作负极,Ag作正极,电解质溶液为CuSO4溶液不是含Fe3+的盐溶液,故B错误.
C.铁的活泼性小于Zn,Zn作负极,Fe作正极,所以不能实现该反应的原电池,故C错误.
D.铁的活泼性强作负极,C为非金属作正极,电解质溶液为Fe(NO3)3溶液,所以是能实现该反应的原电池,故D正确.
故选D.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度确定原电池的电极材料及电解质溶液.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->IO3->Cl2 | B. | ClO3->BrO3->Cl2>IO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
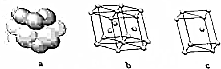 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com