
| A、混合气体中一定有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中可能有乙炔 |
| 3.6g |
| 18g/mol |
| 3.6g |
| 18g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 试剂 | 离子方程式 | |
| ①NaHCO3溶液(Na2CO3) | ||
| ②Fe2O3(Al2O3) | ||
| ③FeCl3溶液(FeCl2) | ||
| ④CO2(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可证明铁生锈时空气参与反应 |
B、 装置可除去乙烯中混有的少量SO2 |
C、 装置可用于分离沸点不同且互溶的液体混合物 |
D、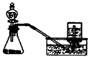 装置可用铜和浓硝酸反应制取少量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学按如图所示的装置进行电解实验.下列说法正确的是( )
某同学按如图所示的装置进行电解实验.下列说法正确的是( )| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极不可能有铜析出 | ||||
C、电解初期,主反应方程式为:Cu+H2SO4
| ||||
| D、整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、加入水稀释
| ||
| B、加水稀释,醋酸的电离度虽然增大,但溶液中各种离子的浓度均减小 | ||
| C、因为醋酸钠水解显碱性,故加入少量的醋酸钠固体,平衡向电离方向移动 | ||
| D、该溶液pH增大时,CH3COO-浓度也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5个 | B、6个 | C、7个 | D、8个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com