

分析 (1)石灰乳是氢氧化钙,根据题干信息以及元素守恒书写化学反应方程式即可;
(2)碱式氯化镁表面会附着氯化镁、氯化钙、氢氧化钙等杂质;
(3)根据氢氧化镁的流程步骤分析即可;
(4)Mg(OH)2和Al(OH)3分解吸热,生成高熔点的氧化镁、氧化铝;
根据等质量的氢氧化物分解时吸收的热量相对大小分析;
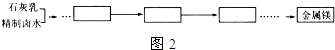
(5)提取镁的流程中,先加入熟石灰,熟石灰与精制卤水中的氯化镁反应得到氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气.
解答 解:(1)石灰乳是氢氧化钙,MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],依据元素守恒,化学反应方程式为:2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClx•mH2O]+(2-x)CaCl2;
故答案为:2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClx•mH2O]+(2-x)CaCl2;
(2)此反应除生产氢氧化镁外,还生成MgCl2、CaCl2,另外还可能剩余氢氧化钙,所以水洗的目的是除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等;
故答案为:除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等;
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点,上述工艺流程中与此有关的步骤是水热处理和表面处理,
故答案为:水热处理、表面处理;
(4)Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧,且同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,使阻燃效果更佳,
Mg(OH)2的吸热效率为:$\frac{81.5kJ/mol}{58g/mol}$=1.41 kJ•g-1;Al(OH)3的吸热效率为:$\frac{87.7kJ/mol}{78g/mol}$=1.12 kJ•g-1,质量的Mg(OH)2比Al(OH)3吸热多,所以阻燃效果较好的是Mg(OH)2;
故答案为:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳;
Mg(OH)2;Mg(OH)2的吸热效率为81.5kJ•mol-1÷58g•mol-1=1.41 kJ•g-1,Al(OH)3的吸热效率为87.7kJ•mol-1÷78g•mol-1=1.12 kJ•g-1,等质量的Mg(OH)2比Al(OH)3吸热多;
(5)提取镁的流程中,先加入熟石灰,熟石灰与精制卤水中的氯化镁反应得到氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气,故此流程如下: ;
;
故答案为: .
.
点评 本题以工业生产工艺流程为载体,考查化学与技术、物质的分离提纯、运用化学知识解决实际问题等,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
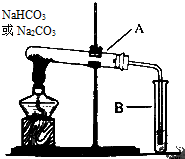 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS | |
| D. | 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
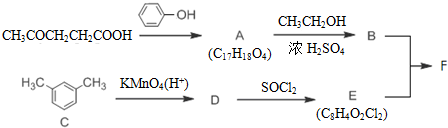
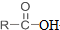 +SOCl2→
+SOCl2→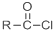 +SO2+HCl
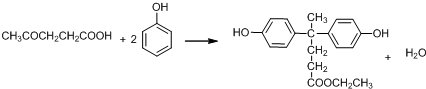
+SO2+HCl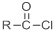 +R′OH→
+R′OH→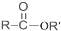 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)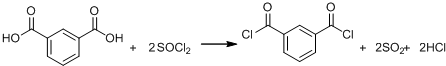 .
. .
. 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com