

分析 (1)电解食盐水生成NaOH、H2和Cl2,以此书写离子方程式;
(2)钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳;依据原子守恒配平写出;
(3)TiCl4水解生成TiO2•xH2O,再经焙烧制得TiO2,水解为吸热反应,从平衡移动角度分析;
(4)根据盖斯定律,①×2-②可得;Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化;
(5)根据甲醇的物质的量计算需要CO、H2的物质的量,根据n(CO)计算电解中生成的n(Cl2),进而计算电解生成n(H2),据此计算解答.
解答 解:(1)电解食盐水生成NaOH、H2和Cl2,反应的化学方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,由方程式得出生成2molTiCl4转移14mol电子,所以生成1mol四氯化钛时转移电子的物质的量为7mol;
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;7;
(3)水解时需加入大量的水并加热,由TiCl4+(2+x) H2O?TiO2•xH2O↓+4HCl可知,加入大量水并加热,HCl挥发,温度升高,都能使水解反应向正反应方向进行,促进水解趋于完全,
故答案为:发生反应TiCl4+(2+x)H2O?TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,温度升高,都能促使水解正向进行;
(4)反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ•mol-1,反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,Ar气中防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应
故答案为:-512 kJ•mol-1;Mg和Ti都有强还原性,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应,在Ar气氛中可以防止被氧化;
(5)由CO(g)+2H2(g)?CH3OH(g)可知,合成6mol甲醇需要n(CO)=6mol、n(H2)=12mol.根据2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=$\frac{7}{6}$n(CO)=7mol,根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=7mol,故需额外补充H2 为12mol-7mol=5mol,V=5×22.4=112L;
故答案为:112.
点评 本题考查化学方程式的书写及计算、盖斯定律计算、电解原理和计算应用等,题目难度中等,注意根据题干信息的分析判断.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸的氧化性强于稀硝酸 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| D. | 原子半径:Al>Si>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 下列物质的沸点按由低到高的顺序排列为CH3(CH2)2CH3<CH3(CH2)3CH3<(CH3)3CCH3<(CH3)2CHCH2CH3 | |
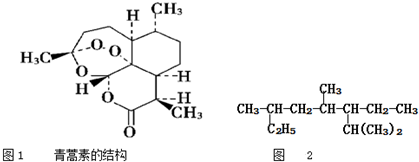
| B. | 青蒿素是抗疟疾特效药,结构如图1所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 按系统命名法命名时,图2有机物的名称是3,5,7-三甲基-6-乙基辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
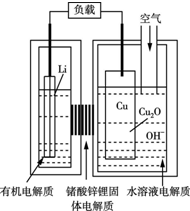 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )| A. | 放电时,电子通过固体电解质向Cu极移动 | |
| B. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e─=2Cu+2OH─ | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
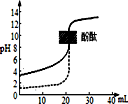
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2=△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com