
£Ø1£©ŌŚ¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠĶØČėN2ŗĶH2£¬ĻĀĮŠÄÜĖµĆ÷“ļµ½Ę½ŗāµÄŹĒ________”£
| A£®3v£ØN2£©£½v£ØH2£© |
| B£®¶ĻĮŃ1øöN”ŌNµÄĶ¬Ź±¶ĻĮŃ6øöN”ŖH |
| C£®N2”¢H2”¢NH3µÄĪļÖŹµÄĮæÖ®±ČŹĒ1”Ć3”Ć2 |
| D£®ČŻĘ÷ÄŚĘųĢåµÄŃ¹Ēæ²»±ä |

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚČÜŅŗÖŠ£¬·“Ó¦A£«2B C·Ö±šŌŚČżÖÖ²»Ķ¬ŹµŃéĢõ¼žĻĀ½ųŠŠ£¬ĖüĆĒµÄĘšŹ¼ÅØ¶Č¾łĪŖc(A)£½0.100 mol/L”¢c(B)£½0.200 mol/L¼°c(C)£½0 mol/L”£·“Ó¦ĪļAµÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
C·Ö±šŌŚČżÖÖ²»Ķ¬ŹµŃéĢõ¼žĻĀ½ųŠŠ£¬ĖüĆĒµÄĘšŹ¼ÅØ¶Č¾łĪŖc(A)£½0.100 mol/L”¢c(B)£½0.200 mol/L¼°c(C)£½0 mol/L”£·“Ó¦ĪļAµÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£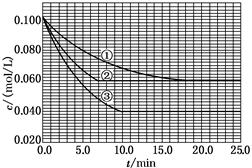
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Óė¢Ł±Č½Ļ£¬¢ŚŗĶ¢Ū·Ö±š½öøıäŅ»ÖÖ·“Ó¦Ģõ¼ž”£ĖłøıäµÄĢõ¼žŗĶÅŠ¶ĻµÄĄķÓÉŹĒ£ŗ
¢Ś______________________________________________£»
¢Ū______________________________________________£»
(2)ŹµŃé¢ŚĘ½ŗāŹ±BµÄ×Ŗ»ÆĀŹĪŖ________£»ŹµŃé¢ŪĘ½ŗāŹ±CµÄÅضČĪŖ________________£»
(3)øĆ·“Ó¦µÄ¦¤H________0£¬ĘäÅŠ¶ĻĄķÓÉŹĒ_________________________________£»
(4)øĆ·“Ó¦½ųŠŠµ½4.0 minŹ±µÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗ
ŹµŃé¢Ś£ŗvB£½________£»
ŹµŃé¢Ū£ŗvC£½________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ij»šµē³§µÄĶŃĮņĪ²ĘųĶØČė±„ŗĶK2CO3ČÜŅŗĪüŹÕ³Ųŗ󣬾·Ö½ā³ŲÖĘµĆ“æ¾»µÄCO2£¬ŌŁŌŚŗĻ³ÉĖžÓėH2·“Ӧɜ³É¼×“¼”£Ę乤ŅÕŅÕĮ÷³ĢŹ¾ŅāĶ¼ČēĻĀ:
£Ø1£©ĪüŹÕ³ŲÖŠ±„ŗĶK2CO3ČÜŅŗĪüŹÕCO2µÄĄė×Ó·½³ĢŹ½ŹĒ ”£
£Ø2£©Į÷³ĢŹ¾ŅāĶ¼ÖŠŃ»·Ź¹ÓƵÄĪļÖŹŹĒ ”£
£Ø3£©300”ꏱ£¬ŗĻ³ÉĖžÖŠµÄ·“Ó¦ĪŖCO2(g)£«3H2(g) CH3OH(g)£«H2O(g)£¬ŌŚĆܱÕĢõ¼žĻĀ£¬ĻĀĮŠŹ¾ŅāĶ¼ÄÜĖµĆ÷·“Ó¦½ųŠŠµ½t1Ź±æĢŹ±“ļµ½Ę½ŗāדĢ¬µÄŹĒ (Ģī×ÖÄøŠņŗÅ)
CH3OH(g)£«H2O(g)£¬ŌŚĆܱÕĢõ¼žĻĀ£¬ĻĀĮŠŹ¾ŅāĶ¼ÄÜĖµĆ÷·“Ó¦½ųŠŠµ½t1Ź±æĢŹ±“ļµ½Ę½ŗāדĢ¬µÄŹĒ (Ģī×ÖÄøŠņŗÅ)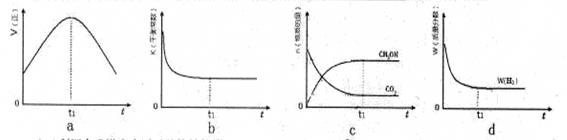
£Ø4£©ĄūÓĆŗĻ³ÉĖžÖŠŹ§»īŗóµÄøõŠæ“„Ć½æÉÖʵĆŗ¬ÓŠCl- ŗĶCrO42- µÄČÜŅŗ£¬ĘäÅØ¶Č¾łĪŖ0.01mol/L£¬ĻņøĆČÜŅŗÖŠÖšµĪ¼ÓČė0.01mol/LµÄAgNO3ČÜŅŗŹ±£¬Ź×ĻČ²śÉś³ĮµķµÄŅõĄė×ÓŹĒ (ŅŃÖŖ:Ksp(AgCl)=1.56”Į10-10£¬Ksp(Ag2CrO4)=9.0”Į10-12)
£Ø5£©ŗĻ³ÉĖžÖŠŹ§»īµÄøõŠæ“„Ć½æÉÓĆÓŚÖʱøŠæĆĢµē³Ų”£ŌŚ¼īŠŌĢõ¼žĻĀ£¬øƵē³ŲµÄ×Ü·“Ó¦ĪŖ£ŗZn(s) £«2MnO2(s) £«H2O(l) = Zn(OH)2(s) £«Mn2O3(s) £¬øƵē³ŲÕż¼«µÄµē¼«·“Ó¦Ź½ŹĒ ”£ČōÓƵē³Ųµē½ā(¶čŠŌµē¼«)×ćĮæµÄMg(NO3)2ŗĶNaClµÄ»ģŗĻČÜŅŗ£¬µē½ā¹ż³ĢÖŠŅõ¼«µÄĻÖĻóŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
½«Ņ»¶ØĮæNO2ŗĶN2O4µÄ»ģŗĻĘųĢåĶØČėĢå»żĪŖ2 LµÄŗćĪĀĆܱÕČŻĘ÷ÖŠ£¬ø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼1ĖłŹ¾”£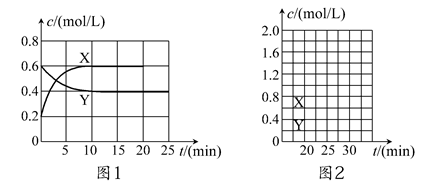
Ēė»Ų“š£ŗ
(1)Ķ¼lÖŠ£¬ĒśĻß________(Ģī”°X”±»ņ”°Y”±)±ķŹ¾NO2ÅضČĖꏱ¼äµÄ±ä»ÆĒéæö£»Ē°10 minÄŚv(NO2)£½________mol/(L”¤min)”£
(2)ĻĀĮŠŃ”ĻīÖŠ²»ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ________(ĢīŃ”Ļī×ÖÄø)”£
| A£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃ¹Ēæ²»Ėꏱ¼ä±ä»Æ¶ųøıä |
| B£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĆÜ¶Č²»Ėꏱ¼ä±ä»Æ¶ųøıä |
| C£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃÕÉ«²»Ėꏱ¼ä±ä»Æ¶ųøıä |
| D£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»Ėꏱ¼ä±ä»Æ¶ų±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
°±ŹĒÖŲŅŖµÄµŖ·Ź£¬ŹĒ²śĮæ½Ļ“óµÄ»Æ¹¤²śĘ·Ö®Ņ»”£æĪ±¾Ąļ½éÉܵÄŗĻ³É°±¼¼Źõ³ĘĪŖ¹ž²®·Ø£¬ŹĒµĀ¹śČĖ¹ž²®ŌŚ1905Äź·¢Ć÷µÄ£¬ĘäŗĻ³ÉŌĄķĪŖ£ŗ
N2(g)£«3H2(g) 2NH3(g) ¦¤H£½£92.4 kJ”¤mol£1
2NH3(g) ¦¤H£½£92.4 kJ”¤mol£1
ĖūŅņ“Ė»ńµĆĮĖ1918ÄźÅµ±“¶ū»Æѧ½±”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŗĻ³É°±¹¤ŅµÖŠ²ÉČ”µÄĻĀĮŠ“ėŹ©æÉÓĆĄÕĻÄĢŲĮŠŌĄķ½āŹĶµÄŹĒ________”£
| A£®²ÉÓĆ½ĻøßŃ¹Ēæ |
| B£®²ÉÓĆ500 ”ęµÄøßĪĀ |
| C£®ÓĆĢś“„Ć½×÷“߻ƼĮ |
| D£®½«Éś³ÉµÄ°±Ņŗ»Æ²¢¼°Ź±“ÓĢåĻµÖŠ·ÖĄė³öĄ“£¬Ź£ÓąN2ŗĶH2Ń»·µ½ŗĻ³ÉĖž |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÓƵŖ»Æ¹č(Si3N4)ĢÕ“É“śĢę½šŹōÖĘŌģ·¢¶Æ»śµÄÄĶČČ²æ¼ž£¬Äܓ󷳶ČĢįøß·¢¶Æ»śµÄČČŠ§ĀŹ”£¹¤ŅµÉĻÓĆ»ÆѧĘųĻą³Į»ż·ØÖʱøµŖ»Æ¹č£¬Ęä·“Ó¦ČēĻĀ£ŗ
3SiCl4(g)£«2N2(g)£«6H2(g)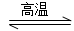 Si3N4(s)£«12HCl(g)””¦¤H<0
Si3N4(s)£«12HCl(g)””¦¤H<0
Ķź³ÉĻĀĮŠĢīæÕ£ŗ
(1)ŌŚŅ»¶ØĪĀ¶ČĻĀ½ųŠŠÉĻŹö·“Ó¦£¬Čō·“ӦȯĘ÷µÄČŻ»żĪŖ2 L,3 minŗó“ļµ½Ę½ŗā£¬²āµĆ¹ĢĢåµÄÖŹĮæŌö¼ÓĮĖ2.80 g£¬ŌņH2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ________mol/(L”¤min)£»øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K£½________”£
(2)ÉĻŹö·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________”£
a£®ĘäĖūĢõ¼ž²»±ä£¬Ń¹ĒæŌö“ó£¬Ę½ŗā³£ŹżK¼õŠ”
b£®ĘäĖūĢõ¼ž²»±ä£¬ĪĀ¶ČÉżøߣ¬Ę½ŗā³£ŹżK¼õŠ”
c£®ĘäĖūĢõ¼ž²»±ä£¬Ōö“óSi3N4ĪļÖŹµÄĮæĘ½ŗāĻņ×óŅʶÆ
d£®ĘäĖūĢõ¼ž²»±ä£¬Ōö“óHClĪļÖŹµÄĮæĘ½ŗāĻņ×óŅʶÆ
(3)Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬ÄܱķŹ¾ÉĻŹö·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ________”£
a£®3vÄę(N2)£½vÕż(H2)
b£®vÕż(HCl)£½4vÕż(SiCl4)
c£®»ģŗĻĘųĢåĆܶȱ£³Ö²»±ä
d£®c(N2)£ŗc(H2)£ŗc(HCl)£½1£ŗ3£ŗ6
(4)ČōĘ½ŗāŹ±H2ŗĶHClµÄĪļÖŹµÄĮæÖ®±ČĪŖm/n£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬½µµĶĪĀ¶Čŗó“ļµ½ŠĀµÄĘ½ŗāŹ±£¬H2ŗĶHClµÄĪļÖŹµÄĮæÖ®±Č________m/n(Ģī”°>”±”¢”°£½”±»ņ”°<”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚĻĀĮŠŹĀŹµÖŠ£¬Ź²Ć“ŅņĖŲÓ°ĻģĮĖ»Æѧ·“Ó¦µÄĖŁĀŹ£æ
(1)¼ÆĘųĘæÖŠÓŠH2ŗĶCl2µÄ»ģŗĻĘųĢ壬ŌŚĘæĶāµćČ¼Ć¾ĢõŹ±·¢Éś±¬ÕØ________£»
(2)»ĘĢśæóģŃÉÕŹ±ŅŖ·ŪĖé³ÉĻøŠ”µÄæóĮ£________£»
(3)KI¾§ĢåŗĶHgCl2¾§Ģå»ģŗĻŗóĪŽĆ÷ĻŌĻÖĻó£¬ČōŅ»ĘšĶ¶ČėĖ®ÖŠ£¬ŗÜæģÉś³ÉŗģÉ«HgI2___________________________£»
(4)ČŪ»ÆµÄKClO3·Å³öĘųÅŻŗÜĀż£¬ČöČėÉŁĮæMnO2ŗóŗÜæģ²śÉśĘųĢå________£»
(5)Ķ¬ÅØ¶Č”¢Ķ¬Ģå»żµÄŃĪĖįÖŠ·ÅČėĶ¬Ńł“󊔵ĊæĮ£ŗĶĆ¾æ飬²śÉśĘųĢåµÄĖŁĀŹÓŠæģÓŠĀż________£»
(6)Ķ¬Ńł“óŠ”µÄŹÆ»ŅŹÆ·Ö±šŌŚ0.1 mol”¤L£1µÄŃĪĖįŗĶ1 mol”¤L£1µÄŃĪĖįÖŠ·“Ó¦ĖŁĀŹ²»Ķ¬________£»
(7)ĻÄĢģµÄŹ³Ę·Ņ×±äĆ¹£¬¶¬Ģģ¾Ķ²»Ņ×·¢ÉśøĆĻÖĻó__________________________________
(8)ĘĻĢŃĢĒŌŚæÕĘųÖŠČ¼ÉÕŹ±ŠčŅŖ½ĻøßµÄĪĀ¶Č£¬æÉŹĒŌŚČĖĢåĄļ£¬ŌŚÕż³£ĢåĪĀ(37 ”ę)Ź±£¬¾ĶæÉŅŌ±»Ńõ»Æ£¬ÕāŹĒŅņĪŖ______________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
10000CŹ±£¬ĮņĖįÄĘæÉÓėĒāĘų·¢Éś·“Ó¦:

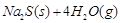 ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÉĻŹö·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗ ”£
£Ø2£©ÉĻŹö·“Ó¦ŌŚČżøö²»Ķ¬Ģõ¼žĻĀ½ųŠŠ£¬ĘäÖŠH2µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£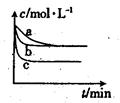
¢ŁÓėĒśĻßa±Č½Ļ£¬bŗĶc·Ö±š½öøıäŅ»ÖÖ·“Ó¦Ģõ¼ž£¬ŌņĒśĻßbøıäµÄĢõ¼žĪŖ
¢ŚøĆ·“Ó¦µÄ”÷H___0£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©£¬ĘäÅŠ¶ĻĄķÓÉŹĒ ”£
£Ø3£©øĆĪĀ¶ČĻĀ£¬Ļņ2LŹ¢ÓŠ1.42g Na2SO4µÄĆܱÕČŻĘ÷ÖŠĶØČėH2,5minŗó²āµĆ
¹ĢĢåÖŹĮæĪŖ1.10g”£ŌņøĆŹ±¼ä·¶Ī§ÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹv(H2)= ”£
£Ø4£©ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ £ØĢī×ÖÄø£¬ĻĀĶ¬£©”£
a.ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
b.ČŻĘ÷ÄŚĘųĢåĆܶȱ£³Ö²»±ä
c.c(H2)=c(H2O)d.vÕż(H2)=vÄę(H2O)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
»Æѧ·“Ó¦ŌĄķŌŚæĘŃŠŗĶÉś²śÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£
£Ø1£©ĄūÓĆ”°»ÆѧÕōĘų×ŖŅĘ·Ø”±Ģį“潚ŹōĪŁµÄ·“Ó¦ŌĄķĪŖW(s)£«I2(g) WI2(g) (I)”£øĆ·“Ó¦ŌŚŹÆÓ¢ÕęæÕ¹ÜÖŠ½ųŠŠ£¬ČēĻĀĶ¼ĖłŹ¾£ŗ
WI2(g) (I)”£øĆ·“Ó¦ŌŚŹÆÓ¢ÕęæÕ¹ÜÖŠ½ųŠŠ£¬ČēĻĀĶ¼ĖłŹ¾£ŗ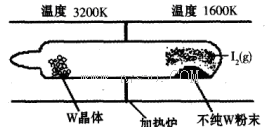
¢Ł·“Ó¦(I)µÄĘ½ŗā³£Źż±ķ“ļŹ½K£½_______£¬ČōK£½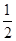 £¬ĻņijŗćČŻĆܱÕČŻĘ÷ÖŠ¼ÓČė1mol I2(g)ŗĶ×ćĮæW(s)£¬·“Ó¦“ļµ½Ę½ŗāŹ±I2(g)µÄ×Ŗ»ÆĀŹĪŖ__________”£
£¬ĻņijŗćČŻĆܱÕČŻĘ÷ÖŠ¼ÓČė1mol I2(g)ŗĶ×ćĮæW(s)£¬·“Ó¦“ļµ½Ę½ŗāŹ±I2(g)µÄ×Ŗ»ÆĀŹĪŖ__________”£
¢Ś·“Ó¦(I)µÄ”÷H____0£ØĢī”°£¾”±»ņ”°£¼”±£©£¬ÉĻŹö·“Ó¦ĢåĻµÖŠæÉŃ»·Ź¹ÓƵÄĪļÖŹŹĒ_________”£
¢ŪÄܹ»ĖµĆ÷ÉĻŹö·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄÓŠ_________£ØĢīŠņŗÅ£©”£
a£®I2ÓėWI2µÄÅضČĻąµČ
b£®WµÄÖŹĮæ²»ŌŁ±ä»Æ
c£®ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
d£®µ„Ī»Ź±¼äÄŚ£¬½šŹōĪŁĻūŗĵÄĪļÖŹµÄĮæÓėµā»ÆĪŁÉś³ÉµÄĪļÖŹµÄĮæĻąµČ
£Ø2£©25”ꏱ£¬NaHSO3µÄĖ®½āĘ½ŗā³£Źż£½1.0”Į10£12mol/L£¬ŌņøĆĪĀ¶ČĻĀH2SO3 HSO3££«H£«µÄµēĄė³£ŹżKa£½____mol/L£¬ČōĻņH2SO3ČÜŅŗÖŠ¼ÓČėÉŁĮæµÄI2£¬ŌņČÜŅŗÖŠ
HSO3££«H£«µÄµēĄė³£ŹżKa£½____mol/L£¬ČōĻņH2SO3ČÜŅŗÖŠ¼ÓČėÉŁĮæµÄI2£¬ŌņČÜŅŗÖŠ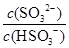 ½«________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
½«________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø3£©Ö±½ÓÅÅ·Åŗ¬SO2µÄŃĢĘų»įŠĪ³ÉĖįÓź£¬Ī£ŗ¦»·¾³”£ÓĆNa2SO3ČÜŅŗĪüŹÕSO2µÄ¹ż³ĢÖŠ£¬pHĖęn£ØSO32££©£ŗn(HSO3£)±ä»Æ¹ŲĻµČēĻĀ±ķ£ŗ
| n(SO32£): n ( HSO3£) | 91:9 | 1:1 | 1:91 |
| pH(25”ę) | 8.2 | 7.2 | 6.2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com