
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 (或
(或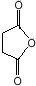 ).
). .
. 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为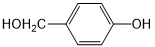 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
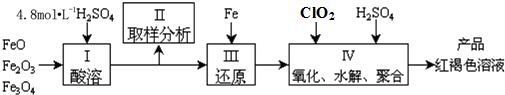
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
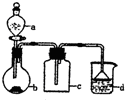 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是| 选项 | A中的物质 | b中的物质 | c中的物质 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
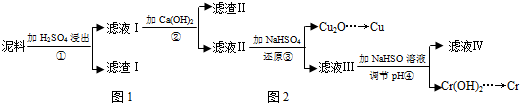
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
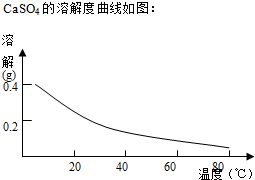
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com