
(8分)已知水在25℃和95℃时,其电离平衡曲线如图所示:
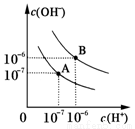
(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”),请说明理由 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8。请分析其原因: 。
(1)A 温度越高KW越大 (2)10:1 (3)pH1+pH2=14 (4)BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性
【解析】
试题解析:(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)?c(OH-)=10-12 ;水的电离时吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线,故答案为:A;温度升高促进水的电离 Kw增大;(2)25°C时纯水的pH=7,混合溶液的pH=7,说明酸、碱混合时碱过量溶液恰好反应pH=9的NaOH溶液c(OH-)=10-5 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,设碱的体积为x,酸的体积为y,,10-5 ×x=10-4×y,则x:y=10:1,答:碱的体积必是酸的10倍;(3)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12.现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14;(4)曲线B对应温度下,纯水的pH=6,pH=2的HCl溶液中(H+)=10-2mol/L,pH=10的某BOH溶液c(OH-)=10-2mol/L,等体积混合后,若BOH为强碱,则溶液呈中性,则PH=6,而实际PH=8,则说明BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性。
考点:弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关PH的计算


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(用NA表示阿伏加德罗常数的值)
A. L B.
L B. L C.
L C. L D.
L D. L
L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:填空题
怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)NaHCO3溶液中混有Na2CO3
(3)FeCl2溶液中混有CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
下列物质与铁反应后的生成物,能与KSCN溶液作用生成红色溶液的是
A、盐酸 B、氯气 C、CuSO4溶液 D、稀硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.Cu(OH)2难溶于水,属于非电解质
B.NH4Cl组成中不含金属离子,不属于盐
C.SO2溶于水能导电,SO2属于电解质
D.HCl气体溶于水电离成H+和Cl-,属于电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
将K2SO4、Al2(SO4)3、KAl(SO4)2三种盐混合,溶解于硫酸酸化的水中,测得c(SO)=0.125 mol·L-1,c(Al3+)=0.065 mol·L-1,c(K+)=0.045 mol·L-1,假设溶液中H2SO4完全电离为H+和SO,则溶液的pH为
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1 mol SO3
B.保持温度和容器压强不变,充入1 mol SO3
C.保持温度和容器压强不变,充入1 mol O2
D.保持温度和容器压强不变,充入1 mol Ar
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:选择题
常温下测得某无色溶液中由水电离出c(H+)为10-13 mol/L, 该溶液中一定能大量共存的离子组是
A.K+、Na+、NO3-、SO42- B.K+、Na+、Cl-、CO32-
C.Mg2+、K+、NO3-、Cl- D.Fe2+、NO3-、SO42-、NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com