
| A. | CH3CH(OH)CH3 | B. | CH3CH2CH2CH2OH | C. | CH3CH2CH2OH | D. | CH3CH2OCH2CH3 |
分析 该有机物分子中有分子中含有C-H键、O-H键、C-O键;核磁共振氢谱中有几个不同的峰,分子中就有几种H原子,有机物中有4个吸收峰,说明分子中有4种H原子,据此判断.
解答 解:A、CH3CH(OH)CH3分子中有C-H键、O-H键、C-O键,分子中3化学环境不同的H原子,核磁共振氢谱有3个吸收峰,故A错误;
B、CH3CH2CH2CH2OH中含有C-H键、O-H键、C-O键,分子中5种化学环境不同的H原子,核磁共振氢谱有5个吸收峰,故B错误;
C、CH3CH2CH2OH含有C-H键、O-H键、C-O键,分子中4种化学环境不同的H原子,核磁共振氢谱有4个吸收峰,故C正确;
D、CH3CH2OCH2CH3,含有C-H键、C-O键、不含O-H键,故D错误;
故选C;
点评 本题以共振氢谱为载体考查有机物的结构,难度较小,清楚核磁共振氢谱中有几个不同的峰,分子中就有几种H原子.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
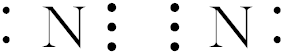 ,
, ,
,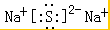 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
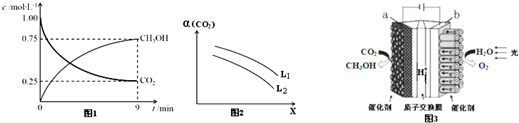
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com