
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
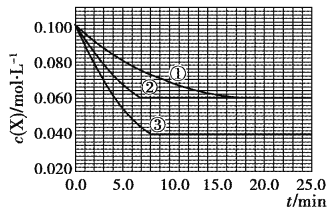
A. 实验②的温度高于实验①的温度
B. 实验②平衡时Y的转化率为60%
C. 实验③与实验①相比,实验③使用了催化剂
D. 反应X(g)+2Y(g)![]() Z(g)的△H>0
Z(g)的△H>0
【答案】D
【解析】
与①比较,②反应速率增大,但与①处于同一平衡状态,则②应为加入催化剂;与①比较,③反应速率增大,可能是升高温度或增大压强,但如是增大压强,减小容器的体积虽然平衡向正反应方向移动,但X的平衡浓度反而增大,不符合图象,则应为升高温度,据此分析解答。
A. 因为①、②的起始浓度相同、平衡浓度相同,②的反应速率比①快,所以实验②应是在有催化剂的条件下进行的,实验②的温度与实验①的温度相同,故A错误;
B. 从图中可以看出,实验②平衡时X的浓度变化量为0.04mol/L,则Y的浓度变化量为0.08mol/L,Y的转化率为40%,故B错误;
C. 实验③与实验①相比,X的浓度变化量大,说明平衡正向移动,而使用催化剂平衡不移动,故C错误;
D. 实验③与实验①相比,X的浓度变化量大,说明平衡正向移动,且化学反应速率加快,故此时的反应条件只能为升温,由此可见,正反应是吸热反应,△H>0,故D正确。
故答案选D。


科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
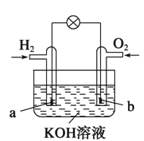
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答下列问题:
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。

B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:

(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<________(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________:
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______周期__________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______性,其中Be(OH)2显示这种性质的离子方程式是____________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________,说出理由并写出判断的方法_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在1L 0.1mol/L碳酸钠溶液中,阴离子总数为0.1NA
B.1mol铁与足量的氯气反应,失去电子数为2NA
C.31g白磷分子中,含有的共价单键数目是NA
D.1mol Na2O2与足量CO2反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液,回答下列问题
(1)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、___。
(2)容量瓶上标有刻度线、___,使用前要___。
(3)需用托盘天平称取Na2CO3____g。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线___,
B.溶解后未冷却到室温就转入容量瓶___,
C.容量瓶内壁附有水珠而未干燥处理___,
D.定容时仰视___,
E.上下颠倒摇匀后液面低于刻线___。
(5)若实验室中要用浓度为16mol/L的浓硫酸配制480mL2.0mol/L的稀硫酸,则需要量取浓硫酸的体积为___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。

回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成n mol A2,同时消耗2n mol AB
B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化
D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究表明,某品牌打火机中的液体燃料为液态的烃甲,其分子中碳、氢原子个数比为2:5,此有机物的分子式为________________,该有机物同系物的通式为_____________,甲可能的结构简式为_____________、_______________;碳、氢个数比为1:2的烃乙可通过与![]() 加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
(2)奥运火炬中使用的燃料为混合物,其主要成分为丙烷,请写出丙烷完全燃烧的化学方程式:____________。现将等质量的天然气和丙烷分别与足量氧气反应,则前者与后者消耗氧气的质量之比为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com