
�����12�֣�
������;�㷺�Ľ������ϣ�Ŀǰ��ҵ����Ҫ����������Ҫ�ɷֺ���������������������ȡ�����䳣���Ĺ������£�

��ش��������⣺
39������B����Ϊ������Ʒ���ۣ�����;Ϊ ����ҺC���������� ��
40������ʵ����ģ��������������IV��ԭ������ �н��У�ȷ���ù���ת����ȫ�ķ����ǶԲ�Ʒ�������������г����� ��
41��д���ٹ����з�����Ӧ�����ӷ���ʽ �����������У�NaOH��CO2��H2O�� ����ѭ��ʹ�á�
42����ʱ������õ�����ҺΪNa2CO3��NaHCO3�Ļ����Һ��ȡ��Ʒ��Һ50.00mL��ˮϡ�͵�1L������ȡ��20mL��������Һ������������Ƚ���ϴ�ӵ�ϴ��Һ����Ϊ�� ������Һ��������ķ����Ƕ��� ��Ӧ�Ŀ̶�ֵ��
43���ñ����ᣨ0.2000mol/L�����еζ���
��������ȡ20.00mL��Һ����̪��ָʾ�������ı�����12.00mL��
�ڴ�1Lϡ��Һ����ȡ10.00mL��������ָʾ�������ı�����15.00mL��
��50.00mLԭ��Ʒ��Һ��̼�����Ƶ�Ũ��Ϊ ��
44������III����ʱ��ΪʹD��Һ��ֻ��һ�����ʣ���ÿ����Һ���������ʯ�ҵ�����Ϊ ��
����12�֣�39.�������ɫ���� ��1��)�� AlO2����OH- (1�֣� OH����д���۷�)
40.������1�֣��ٽ������ա���ȴ��������ֱ���������γ����Ľ��������0.001g������к��ز�������1��)��
41.Al2O3+2OH��=2AlO2��+H2O (1�֣���ƽ����д����ѧʽ������)��CaO ��1��)
42.����ˮ������ˮ������Һ��1�֣������밼Һ����ʹ����У�1��)
43.1.2mol/L (2��) 44��201.6g(2��)
��������
���������39.������ĺ����������������������м���ǿ����Һ���ᷢ����Ӧ��Al2O3+ 2OH-= 2AlO2-+ H2O���������������ܽ⣬Ȼ����ˣ��õ�����ҺC�к���AlO2-������B�к���������������B����Ϊ������Ʒ���ۣ�����;Ϊ�������ɫ���ϣ���ҺC����������AlO2����OH-��
40.��Al(OH)3���գ������ֽⷴӦ����Al2O3��Ȼ�������ڵ�����������Al������������ʵ����ģ��������������IV��ԭ�����������н��У�ȷ���ù���ת����ȫ�ķ����ǶԲ�Ʒ�������������г�������ز��������ٽ������ա���ȴ��������ֱ���������γ����Ľ��������0.001g��
41.�ٹ����з�����Ӧ�����ӷ���ʽ��Al2O3+ 2OH-= 2AlO2-+ H2O�����������У�������CaCO3���ղ�����CaO��NaOH��CO2��H2O����ѭ��ʹ�á�
42����ʱ������õ�����ҺΪNa2CO3��NaHCO3�Ļ����Һ��ȡ��Ʒ��Һ50.00mL��ˮϡ�͵�1L������ȡ��20mL��������Һ������������Ƚ���ϴ�ӵ�ϴ��Һ����Ϊ����������ˮ���ζ���ϴ�Ӹɾ���Ϊ��ֹˮ����������Ӱ������Ũ�ȵIJⶨ����������ˮϴ�ӣ�Ϊʹ�γ�����Һ��ԭ�������ҺŨ����ͬ������ô���Һ��ϴ������Һ��������ķ���������Ҫƽ�ӣ������밼Һ����ʹ����ж�Ӧ�Ŀ̶�ֵ��
43���ñ����ᣨ0.2000mol/L�����еζ�����������ȡ20.00mL��Һ����̪��ָʾ�������ڷ�̪�ı�ɫ����8.1����ʱ�����ķ�Ӧ�ǣ�Na2CO3+ HCl=NaCl+ NaHCO3��n(Na2CO3)=n(HCl)= 0.2000mol/L��0.012L=2.4��10-3mol; ����ԭ50ml��Һ�к���Na2CO3�����ʵ�����n(Na2CO3)=2.4��10-3mol��(1000ml��20ml)=0.12mol;�ڴ�1Lϡ��Һ����ȡ10.00mL,�Լ�����ָʾ�������ڼ��ȵı�ɫ����4.4����ʱ�����ķ�ӦΪ��Na2CO3+ 2HCl=2NaCl+H2O+ CO2����NaHCO3+HCl=NaCl+H2O+ CO2�������ݢٿ�֪��10.00ml��Һ�к���Na2CO3�����ʵ�����1.2��10-3mol;����һ�����ı�����15.00mL������10.00ml��Һ�к���NaHCO3�����ʵ�����n(NaHCO3)= 0.2000mol/L��0.015L-2��1.2��10-3mol=1.2��10-3mol����ô��ԭ50ml��Һ�к���NaHCO3�����ʵ�����6��10-4mol��(1000ml��10ml)=0.06mol;��50.00mLԭ��Ʒ��Һ��̼�����Ƶ�Ũ��Ϊc(NaHCO3)=0.06mol��0.05L=1.2mol/L��
44����������Һ��������Һ��Na2CO3��NaHCO3�Ļ����Һ����50ml��Һ�к���n(Na2CO3)=0.12mol��n(NaHCO3)= 0.06mol,����1L��Һ�к��е����ʵ����ʵ����ǣ�n(Na2CO3)= 0.12mol��(1000ml��50ml)=2.4mol��n(NaHCO3)= 0.06mol��(1000ml��50ml)=1.2mol������в���III����ʱ��CaO��H2O������Ӧ����Ca(OH)2, Ca(OH)2��Na2CO3��NaHCO3������Ӧ����CaCO3��NaOH��ˮ��ΪʹD��Һ��ֻ��ֻ����NaOHһ�����ʣ������Ԫ���غ�ɵ�n(CaO)=n(CaCO3)= n(Na2CO3)+ n(NaHCO3)= 2.4mol+1.2mol=3.6mol������ÿ����Һ���������ʯ�ҵ�����Ϊm(CaO)= 3.6mol��56g/mol=201.6g��
���㣺����Al2O3�����ʡ�Fe2O3����;�������ķ��뷽�������ʺ����IJⶨ����Ӧ��ע�����������ʹ�á���Ӧ�����ӷ���ʽ����д�����ʵ�ѭ�����õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���к�����������ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
��11�֣�����ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ_________��
�����з����У�����ʹ����ϡ��Һ��CH3COOH����̶��������__________������ĸ��ţ���
a���μ�����Ũ���� b������Һ
c����ˮϡ�� d���������������ƾ���
��2����0.1 mol��L-1NaOH��Һ�ֱ�ζ������Ϊ20.00 mL��Ũ�Ⱦ�Ϊ0.1mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�
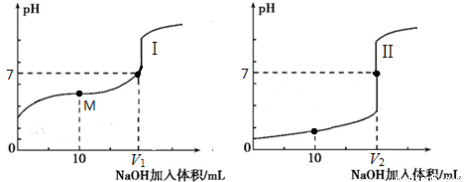
�ٵζ������������_____���I������
�ڵζ���ʼǰ��������Һ����ˮ�������c(H+)������_____��
��V1��V2�Ĺ�ϵ��V1_____V2���>������=����<������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳����_________��
��3��Ϊ���о������ܽ�ƽ��ͳ���ת����ijͬѧ�������ϲ��������ʵ�顣
���ϣ�AgSCN�ǰ�ɫ��������ͬ�¶��£��ܽ�ȣ�AgSCN > AgI��
�������� | ���� |
����1����2 mL 0.005 mol��L-1 AgNO3��Һ�м���2 mL 0.005 mol��L-1 KSCN��Һ�����á� | ���ְ�ɫ������ |
����2��ȡ1 mL�ϲ���Һ���Թ��У��μ�1��2mol��L-1 Fe(NO3)3��Һ�� | ��Һ���ɫ�� |
����3������2����Һ�У���������5��3 mol��L-1 AgNO3��Һ�� | ����a����Һ��ɫ��dz�� |
����4������1���µ���Һ�м���5��3 mol��L-1 KI��Һ�� | ���ֻ�ɫ������ |
��д������2����Һ���ɫ�����ӷ���ʽ__________________��
�ڲ���3������a��_____________________��
���û�ѧƽ��ԭ�����Ͳ���4��ʵ������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ����ݸ���ͳһ������ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
����ѧ��ѡ��5���л���ѧ��������15�֣�
����ʽΪC8H10���л���A��������Ӧ���ɲ����ж��֣�����֮һB�ɷ�������ת���ϳɾ�����߷��Ӳ���

��ϳ�·�����£�

��֪����ͬһ̼ԭ�����������ǻ�ʱ�ṹ���ȶ�������ˮ����ȩ��ͪ��

������C�ɷ���������Ӧ��
�����������Ϣ�ش��������⣺
��1��B�Ľṹ��ʽΪ �����еĹ���������Ϊ ��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
C��������Һ�ķ�Ӧ ��
��D���ɸ߷��ӻ�����ķ�Ӧ ��
��3��C��ͬ���칹�������ڷ����廯�������ܷ���ˮ�ⷴӦ���� �֣����м��ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ���� �֡�
��4�������Լ����л��ϳɷ�����;�㷺������±������þ�������ܼ��з�Ӧ�Ƶá���RΪ��������֪��
R��X+Mg R��Mg X�������Լ�����
R��Mg X�������Լ�����

����������Ϣ����C���ʺ����Լ��ϳ���һ�ָ߷��ӻ�����

�ںϳɹ��������õĸ����Լ��Ļ�ѧʽΪ ����X��ʾ±ԭ�ӣ����ϳɹ������漰�����л���ѧ��Ӧ������ �����ţ�
A���ӳɷ�Ӧ B���Ӿ۷�Ӧ C��������Ӧ D�����۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ���ָ���1�·�ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(15�֣�������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m 1 g�û�����ʯ����Ʒ������ͼװ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ��

�䷴Ӧ�Ļ�ѧ����ʽΪ��4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
��ʵ��һ���ⶨ��Ԫ�صĺ���
��Ӧ��������ƿ�е���Һ�������´�����

��1�����������������________________________________________________________��
��2����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ��û�ѧ����ʽ��ʾ��_________��H2O2���Կ�����һ�ֺ������ᣬд������뷽��ʽ�� ��
��3���û�����ʯ����Ԫ�ص���������Ϊ ���г�����ʽ���ɣ���
��ʵ������ⶨ��Ԫ�صĺ���

��4�����У�������������ԭ����������õ���Ԫ�صĺ���_______���ƫ����ƫС������Ӱ�족����
��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_________________��
��6��ijͬѧһ���������Ĵεζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 20.00 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ���ָ���1�·�ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�ױ���һ�ȴ�����4�֣���ױ���������ȫ�ӳɺ�����һ�ȴ������������
A��2�� B��4�� C��5�� D��7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��г����ظ�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��100mL 0.1mol? L-1������泥�NH4Al(SO4)2����Һ����ε���0.1mol ��L-1Ba(OH)2��Һ������Ba(OH)2��Һ���(V)�ı仯�����������ʵ���(n)�ı仯����ͼ��ʾ������������ȷ����
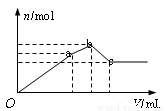
A��a��ij��������ʵ���Ϊ0.03mol
B��oa�η�����Ӧ�����ӷ���ʽ�ǣ�Al3++2SO42-+2Ba2++3OH-= 2BaSO4��+Al(OH)3����
C��ab�η�����Ӧ�����ӷ���ʽ�ǣ�2NH4++SO42-+Ba2++2OH-=2NH3?H2O+ BaSO4��
D����Ӧ��c��ʱ������Ba(OH)2��Һ�������Ϊ250mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��г����ظ�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H2(g) + Br2(g) �� 2HBr(g) ��H= ��72 kJ/mol��1mol Br2(g)Һ���ų�������Ϊ30 kJ����������������±��������������е�aֵΪ
һ��״̬�ķ��� | H2(g) | Br2(l) | HBr(g) |
1 mol�÷����еĻ�ѧ���������յ�����/kJ | 436 | a | 369 |
A��404 B��344 C��260 D��200
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ����Ԫ��ģ����Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣�ijǿ������ҺX����Ba2+��Al3+��NH4+��Fe2����Fe3+��CO32-��SO32-��SO42-��NO3-�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������£�

����������Ϣ���ش��������⣺
��1�����������У���ҺX�г�H����϶����е�������____________________������ȷ���Ƿ��е�������___________��
��2������G�Ļ�ѧʽΪ_____________��
��3����������A�����ӷ���ʽ____________________��
��4�����˲�������ʹ�õ��IJ�������������Ϊ____________________��
��5������ʵ���Ҽ�������F�ķ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014--2015����ʡ��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����ӦA(HCl)��B(Cl2)��C(NaClO)��D(HClO)��E(CO2),���в���ֱ��һ��ʵ�ֵ���
A��A��B B��B��C C��C��D D��D��E
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com