
| A. | HCl | B. | CO2 | C. | NH3 | D. | CO |
科目:高中化学 来源: 题型:多选题
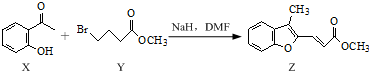
| A. | 物质X在空气中不易被氧化 | |
| B. | 物质Y中只含1个手性碳原子 | |
| C. | 物质Z中所有碳原子可能在同一平面内 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =8.4 | B. | >8.4 | C. | <8.4 | D. | ≤8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.7% | B. | 8.7% | C. | 9% | D. | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
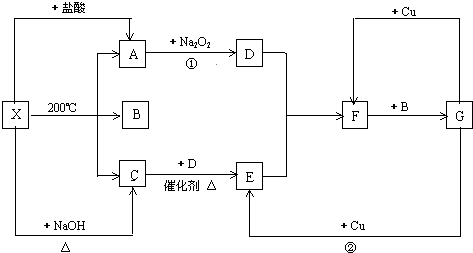
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
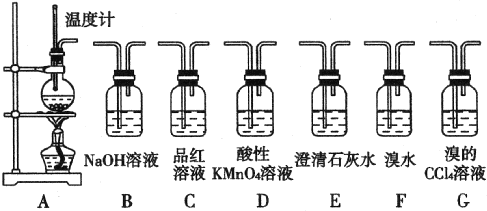
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
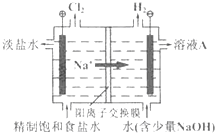 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| B. | 使用催化剂可以提高SO2的转化率 | |
| C. | 反应在450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2moLSO2(g)和1moLO2(g)所含的总能量小于2moLSO3(g)所含的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
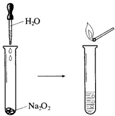 Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.
Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com