
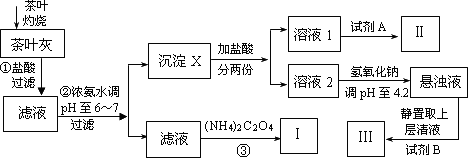
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是________.
(2)步骤②中调节pH至6~7的目的是________.
(3)沉淀X所含主要物质的化学式为________.
(4)写出步骤③中发生反应的离子方程式:________.
(5)试剂A为________;试剂B为铝试剂,加入该试剂后的实验现象是________.
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| Cu |
| 加热 |
| Cu |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊市高三3月模拟考试(一模)化学试卷(解析版) 题型:填空题
下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
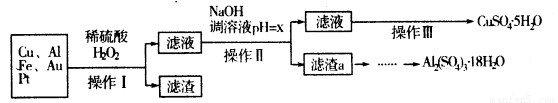
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
开始沉淀 | 1.1 | 4.0 | 5.4 |
完全沉淀 | 3.2 | 5.2 | 6.7 |
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:????????????? .。
(2)在操作Ⅱ中,x的取值范围是???????????? ? 。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有??????????? 。
(4)由滤渣a制取Al2(SO4)3·l8H2O,探究小组设计了三种方案:
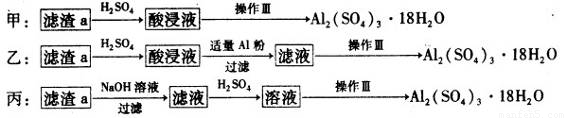
综合考虑上述三种方案,最具可行性的是?????? (填序号)。
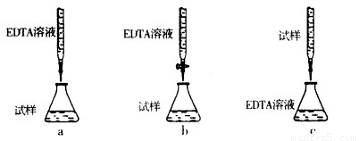
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 ?????????? 。
②下列滴定方式中,最合理的是(夹持部分略去) ??????????? (填序号)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省荆州市高三3月第二次质量检查理综化学试卷(解析版) 题型:实验题
为测定某补血剂样品〔主要成分是硫酸亚铁晶体(FeSO4·7H2O)〕中铁元素的含量,某化学兴趣小组设计了两套实验方案:
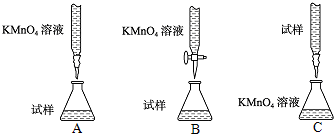
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
⑴写出滴定反应的离子方程式 。
(2)下列滴定方式中,最合理的是 (夹持仪器略去)(填字母序号〕

(3)实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_ (填仪器名称)。
(4)若某同学取5片补血剂样品配成100 mL溶液,取20. 00 mL试样,用浓度为c1mol·L-1的KMnO4溶液滴定,耗去V1 mL,则每片补血剂含铁元素的质量_ g(用代数式表示)。
方案二:将FeSO4转化为Fe2O3,测定质量变化。操作流程如下:
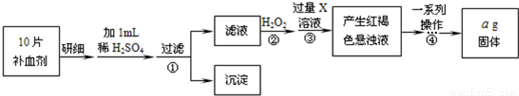
(5)步骤②中用H2O2的目的是_ _。
(6)步骤④中一系列操作依次是:过滤、洗涤、_ 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量为_ g(用含a的代数式表示)。
(8)若某同学设计以原电池的形式实现Fe2+至Fe3+的转化,正极通人O2,电解质溶液为稀硫酸,请写出正极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com