
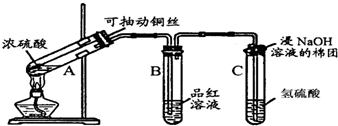
分析 由实验装置图可知:装置A铜与浓硫酸反应生成二氧化硫,装置B验证二氧化硫的漂白性、装置C验证二氧化硫的氧化性,在试管C口部的棉团上SO2与强碱发生复分解反应,体现二氧化硫具有酸性氧化物的性质;
(1)在试管C口部的棉团上SO2与强碱发生复分解反应的离子方程式是;
(2)试管C中SO2与H2S发生反应产生了难溶于水的S沉淀;
(3)若将试管B中的溶液换成酸性KMnO4溶液,酸性KMnO4有氧化性,会把SO2氧化为硫酸,而其本身被还原为Mn2+;
(4)SO2能使品红溶液褪色,加热褪色后的溶液,溶液又变红色.
解答 解:由实验装置图可知:装置A铜与浓硫酸反应生成二氧化硫,装置B验证二氧化硫的漂白性、装置C验证二氧化硫的氧化性,在试管C口部的棉团上SO2与强碱发生复分解反应,体现二氧化硫具有酸性氧化物的性质;
(1)在试管C口部的棉团上SO2与强碱发生复分解反应的离子方程式是SO2+2OH-=SO32-+H2O;故答案为:SO2+2OH-=SO32-+H2O;
(2)试管C中溶液变浑浊,是因为SO2与H2S发生反应产生了难溶于水的S沉淀,反应的化学方程式为SO2+2H2S=3S↓+2H2O; 故答案为:SO2+2H2S=3S↓+2H2O;
(3)若将试管B中的溶液换成酸性KMnO4溶液,酸性KMnO4有氧化性,会把SO2氧化为硫酸,而其本身被还原为Mn2+,酸性KMnO4溶液紫红色会褪去,则反应的离子方程式为是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
(4)能使品红溶液褪色的物质有很多,能够证明使品红溶液褪色的是SO2而不是其它物质的方法是加热褪色后的溶液,若溶液又变红色即可证明.
故答案为:加热褪色后的溶液,若溶液又变红色即可证明.
点评 本题考查Cu与浓硫酸发生反应的产物的性质、检验方法、化学方程式和离子方程式的书写的知识,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为4mol | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为1:5 | |
| C. | 3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L | |
| D. | x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑧⑩ | B. | 除③外 | C. | 除④外 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com