
 我国节能减排“十二五规划”要求到2015年,全国二氧化碳排放总量控制在2086.4万吨.若能回收二氧化碳,其对工农业生产中有重要的作用.下列关于干冰(如图)的说法正确的是( )
我国节能减排“十二五规划”要求到2015年,全国二氧化碳排放总量控制在2086.4万吨.若能回收二氧化碳,其对工农业生产中有重要的作用.下列关于干冰(如图)的说法正确的是( )| A、干冰是弱电解质 |
| B、金属着火可以用干冰灭火 |
| C、氧碳两种元素可以组成不同的氧化物 |
| D、干冰在常温常压下稳定存在 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A、溶液显酸性 |
| B、升温,c(X)增大,c(Y)减小 |
| C、c(B+)+c(Y)=c(Cl-) |
| D、稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCOOH+H2O═HCOO-+H3O+ |
| B、CO2+H2O═HCO3-+H+ |
| C、CO32-+H2O═HCO3-+OH- |
| D、HS-═S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A、容器①、②中反应的平衡常数相等 |
| B、达平衡时,两个容器中XY3的物质的量浓度均为2mol?L-1 |
| C、容器②中反应达到平衡时放出的热量为Q |
| D、若将容器①体积缩小为0.20L,则达平衡时放出的热量大于23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
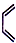 ;
;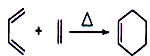
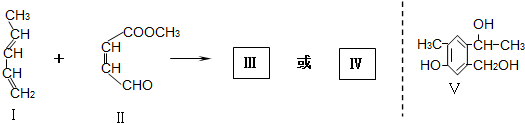
| Br2/CCl4 |
| ① |

| NaOH/醇溶液,△ |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| HBr |
| NaOH口口 |
| 口 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com