
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是_____(填元素符号)。
(2)基态Ti原子的价电子排布式为_____,能量最高的能级有_____个空轨道。
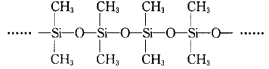
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为_____,以甲基硅油为主要成分的硅橡胶能够耐高温的原因是_____。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为_____,其含有的共价键类型有_____。
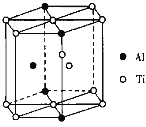
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为_____,其结构单元棱长为apm,底面边长为bpm,该合金的密度为_____g·cm-3。
【答案】Ne 3d24s2 3 sp3杂化 Si—O键的键能大 平面三角形 σ键和π键 Ti11Al5或Al5Ti11 ![]() ×1030
×1030
【解析】
(1)根据第一电离能的周期性变化规律分析解答;
(2)根据电子排布规律、Ti的原子序数可以得出基态Ti原子价电子排布式、能量最高的能级空轨道数目;
(3)按Si原子形成的共价键种类和数目,确定Si原子的杂化方式;硅橡胶能够耐高温反化学键牢固程度来分析;
(4)根据价电子对互斥理论来确定C原子的杂化方式以及C原子与O原子之间的化学键类型;
(5)用均摊法计算晶胞的化学式,按合金的密度即晶胞密度、应用密度的定义计算。
(1)随着原子序数的递增,同一周期的主族元素第一电离能呈递增趋势,碱金属的第一电离能最小,而稀有气体的第一电离能最大,C元素所在的周期为第二周期,则该周期Ne的第一电离能最大;
(2)Ti的原子序数为22,基态Ti原子的电子排布式为[Ar]3d24s2,价电子排布式为3d24s2,能量最高的能级为3d,3d轨道共有五个,按洪特规则,其中有2个轨道分别被2个电子占据,还含有3个空轨道;
(3)甲基硅油结构中Si原子形成4个单键,故Si原子的杂化方式为sp3杂化,硅橡胶能够耐高温,原因是共价键牢固,硅橡胶中含SiO和SiC,SiO更牢固;
(4)CO32中C原子价电子对数=3+![]() =3,且不含孤电子对,CO32空间构型为平面三角形,C原子的杂化方式为sp2杂化,由于CO32空间构型为平面三角形,则C原子与O原子之间存在3个σ键和1个大π键;
=3,且不含孤电子对,CO32空间构型为平面三角形,C原子的杂化方式为sp2杂化,由于CO32空间构型为平面三角形,则C原子与O原子之间存在3个σ键和1个大π键;
(5)Ti原子在结构单元中的位置:顶点8个、面心2个、棱上1个、体内1个,则一个晶胞中,含有Ti的数目为![]() ×8+
×8+![]() ×2+
×2+![]() ×1+1=
×1+1=![]() ,Al原子在顶点有4个,体内1个,则一个晶胞中含有Al的数目为
,Al原子在顶点有4个,体内1个,则一个晶胞中含有Al的数目为![]() ×4+1=
×4+1=![]() ,则化学式为:Ti11Al5或Al5Ti11,则晶胞的密度为ρ=
,则化学式为:Ti11Al5或Al5Ti11,则晶胞的密度为ρ=![]() =
=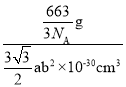 =
=![]() ×1030g/cm3。
×1030g/cm3。


科目:高中化学 来源: 题型:
【题目】美国Lawrece Liermore国家实验室(LINL)成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. ![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B. 在一定条件下,![]() 原子晶体转化为
原子晶体转化为![]() 分子晶体是物理变化
分子晶体是物理变化
C. ![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D. 在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g晶体硅中含有NA个Si-Si键
B.叠氮化铵(NH4N3)发生爆炸反应:NH4N3=2N2![]() +2H2
+2H2![]() ,当产生标准状况下22.4L气体时,转移电子的数目为NA
,当产生标准状况下22.4L气体时,转移电子的数目为NA
C.pH=1的H3PO4溶液中所含H+的数目为0.1NA
D.200mL1mol/LAl2(SO4)3溶液中A13+和SO42-的数目总和是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列有关叙述中不正确的是( )

A.可与NaOH和Na2CO3溶液发生反应
B.1mol该有机物最多与7molH2发生反应
C.1mol该有机物可以与4molBr2发生反应
D.该有机物分子中至少有17个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) ![]() 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.该反应在高温下可能自发
B.若Z的体积分数不再随时间变化时表示反应达平衡状态
C.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
D.35℃时,达平衡时,X分解了0.03 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如图:
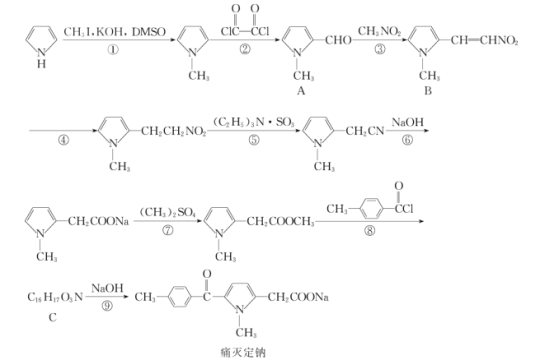
回答下列问题:
(1)化合物B中含有官能团的名称是__。
(2)化学反应①和④的反应类型分别为__和__。
(3)化合物C的结构简式为__。
(4)下列关于痛灭定钠的说法错误的是__。
a.与溴充分加成后官能团种类数不变
b.能够发生水解反应
c.核磁共振氢谱分析能够显示6个峰
d.可使溴的四氯化碳溶液褪色
e.1mol痛灭定钠与氢气加成最多消耗3molH2
(5)反应⑦的化学方程式为__。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:__(不考虑立体异构)。
(7)根据该试题提供的相关信息,写出由化合物![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图。__。
的合成路线图。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。
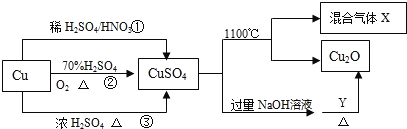
(1)比较途径①②③,途径_______更好地体现了绿色化学思想,其反应的化学方程式:_____
(2)CuSO4在1100℃分解所得气体X可能是SO2、SO3和另一种气体的混合气体,请写出相关化学方程式:________________________。
II.工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如下图
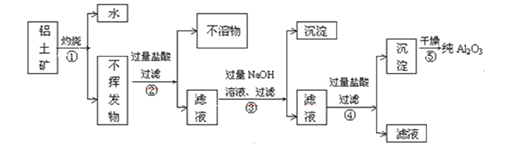
(1)指出图中操作错误的两处是:________________。
(2)步骤②过滤的不溶物是:__________________。
(3)写出步骤③反应(得到④滤液)的主要离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知H2S的燃烧热为akJmol-1 ,S的燃烧热为bkJmol-1 ,则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=______kJmol-1 。
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为_________。
脱硫剂 | 出口硫(mg·m-3) | 脱硫温度(℃) | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)![]() 控制不同的温度和压强进行实验,结果如图(a)。
控制不同的温度和压强进行实验,结果如图(a)。
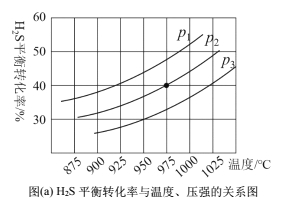
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为______,该反应为____(填“吸热”或“放热”)反应,若要进一步提高H2S的平衡转化率,除了改变温度和压强外,还可以采取的措施有_______。
(4)压强为p、温度为975℃时,![]() 的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如下图(b)。
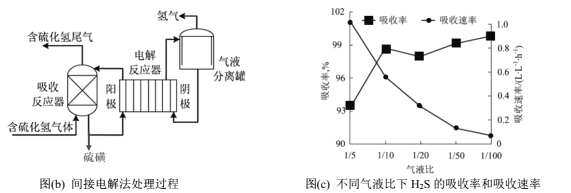
(5)电解反应器总反应的离子方程式为________。
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R五种元素的原子序数依次增大,只有X、Y、Z为短周期元素,相关信息如表:
元素 | 相关信息 |
X | 基态原子核外有3个能级,且各能级电子数目相等 |
Y | 常见化合价只有0、-1、-2 |
Z | 单质为黄绿色有毒气体 |
M | 第四周期d区元素,基态原子的核外有6个未成对电子 |
R | 第五周期,与X处于同一主族 |
(1)元素X、Y电负性的大小顺序是______(用元素符号表示)。
(2)XYZ2分子中所有原子均满足8电子构型,分子中σ键与π键的数目比为______。
(3)元素Y可形成一种氢化物的空间结构如图所示,中心原子Y的杂化方式是______,该分子为______(填“极性”或“非极性”)分子。
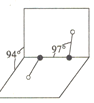
(4)元素M基态原子的价电子排布式为______,MO5中M的化合价为+6价,则该分子中含有过氧键的数目为______。
(5)元素R与Z可形成化合物RZ2,用价层电子对互斥理论推断该分子的空间构型为______,分子中Z-R-Z的键角______120°(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com