
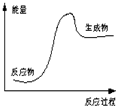
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
分析 A、有图可知生成物的总能量高于反应物的总能量,为吸热反应;
B、有图可知该反应属于吸热反应,而石灰石高温分解属于吸热反应;
C、能量越低越稳定;
D、反应吸热或放热与反应条件无必然联系.
解答 解:A、有图可知成物的总能量高于反应物的总能量,为吸热反应,故A正确;
B、有图可知该反应属于吸热反应,而石灰石高温分解属于吸热反应,所以该图可以表示石灰石高温分解,故B正确;
C、反应物的总能量低于生成物的总能量,根据能量越低越稳定,因此反应物比生成物稳定,故C正确;
D、反应吸热或放热与反应条件无必然联系,并不是所有吸热反应都需要加热,例如氢氧化钡晶体与氯化铵的反应,是常温下即可进行的吸热反应,故D错误;
故选:D.
点评 本题考查化学反应中能量的变化,着重于对概念的理解,注意放热反应、吸热反应与反应物、生成物以及反应速率、反应条件之间有无必然关系,做题时不要混淆.


科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
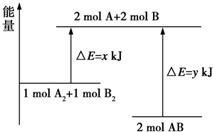
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
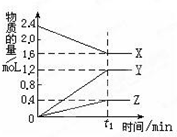 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com