
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.分析 A的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子,为Cu元素,以此解答该题.
解答 解:A的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子,为Cu元素,
(1)由以上分析可知E为Se元素,最外层有6个电子,价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)同周期元素从左到由元素的第一电离能逐渐增大,由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的为N元素,则顺序为N>O>C,故答案为:N>O>C;
(3)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道的类型为sp2,NH4+中心原子形成4个σ键,空间构型为正四面体,
故答案为:sp2;正四面体;
(4)CN-与N2为等电子体,含有C≡N键,则1mol BC-中含有π键的数目为2NA,故答案为:2;
(5)非金属性O>S,元素的非金属性越强,键能越大,对应的氢化物越稳定,则H2O>H2Se,故答案为:H2O;H2Se;H2O中共价键的键能高于H2Se;
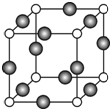
(6)由晶胞结构可知,N原子位于定点,个数为8×$\frac{1}{8}$=1,Cu位于棱,个数为12×$\frac{1}{4}$=3,则化学式为Cu3N,晶胞中位于定点和棱心的位置最近,则N原子的配位数是6,
若相邻C原子和F原子间的距离为a cm,则边长为2acm,晶胞的体积为8a3cm3,晶胞的质量为$\frac{206}{{N}_{A}}$g,则密度为$\frac{\frac{206}{{{N}_{A}}_{\;}}}{8{a}^{3}}$g/cm3=$\frac{103}{4{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu3N; 6;$\frac{103}{4{a}^{3}{N}_{A}}$.
点评 本题考查物质的结构与性质,为高频考点,侧重于学生的分析、计算能力的考查,题目注重对电子排布、晶体类型、熔沸点比较、晶胞计算常考考点的训练,难度中等,注意把握晶胞的计算.


科目:高中化学 来源: 题型:解答题
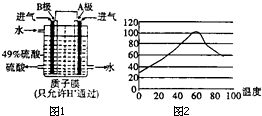 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com