
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),下列说法正确的是
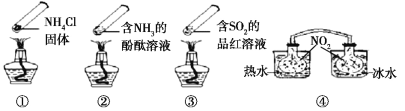
A. 加热时,①封管上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②、③溶液均变红,冷却后又都变为无色
C. ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D. 四个“封管实验”中所发生的化学反应都是可逆反应
科目:高中化学 来源: 题型:
【题目】把浓硫酸滴入浓盐酸中会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸是一种高沸点的酸
C.浓硫酸有脱水性
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃的说法中,正确的是( )
A. 烃是只含碳和氢两种元素的有机物
B. 烃是分子中含有碳元素的化合物
C. 烃是燃烧后生成二氧化碳和水的有机物
D. 烃是含有碳和氢元素的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是( )
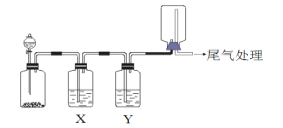
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 用锌与稀盐酸反应制备氢气 | NaOH溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
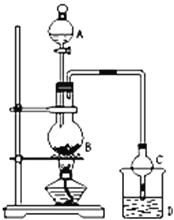
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH
②有关有机物的沸点和密度:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
密度(g/cm3) | 0.714 | 0.789 | 1.049 | 0.903 |
请回答:
(1)仪器A的名称:______;实验前检查装置气密性良好的方法是_______________________;写出烧瓶B中有关反应的化学方程式:______________________________;
(2)球形干燥管C的作用是_______________,若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后,D中的现象是_________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去______;再加入(此空从下列选项中选择,四种物质均有吸水性)____________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.浓硫酸B.碱石灰C.无水硫酸钠D.生石灰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像,以下反应中完全符合上述图像的是( )
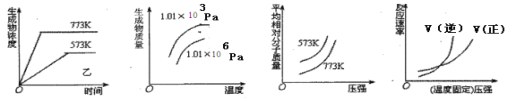
A. N2(g) +3H2 (g) ![]() 2NH3 (g) △H<O
2NH3 (g) △H<O
B. 2SO3 (g) ![]() 2SO2 (g) +O2 (g) △H>O
2SO2 (g) +O2 (g) △H>O
C. 4NH3 (g) +5O2 (g) ![]() 4NO (g) +6H2O (g) △H<O
4NO (g) +6H2O (g) △H<O
D. CO2(g) +NO(g) ![]() CO(g)+NO2(g) △H>O
CO(g)+NO2(g) △H>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有报道称以硼氢化钠(NaBH4,强还原剂)和H2O2作原料的燃料电池,可用作空军通信卫星电源,其工作原理如右图所示。下列说法错误的是( )

A. 电极b作正极,发生还原反应
B. 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
C. 每消耗3 mol H2O2,转移的电子为3 mol
D. 不考虑能量损耗,当有1mol H2O2参加反应时,即有2 mol Na+从a极区移向b极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,浓度均为1 molL-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)="0.58" molL-1,c(B2)="0.16" molL-1,c(C)=0.84molL-1,则该反应的正确表达式为:
A. 2A2+B2![]() 2A2B B. A2+B2
2A2B B. A2+B2![]() 2AB
2AB
C. A2+B2![]() A2B2 D. A2+2B2
A2B2 D. A2+2B2![]() 2AB2
2AB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质均含有同一种元素X,它们之间有如下转化关系:

(1)若A为单质,仅B、C属于盐类,且A、B、C中元素X的化合价依次升高,C、D、E中元素X的化合价相同。则D的颜色为__________;E的名称为____________。
(2)若A为单质,B、C均属于盐类,且B、C的水溶液中含X元素的离子所带电荷数之比为3:1,D是一种白色沉淀。则元素X在周期表中的位置是____________;A→C的反应中氧化剂的化学式为___________;C→D反应的离子方程式为__________________________________。
(3)若A~E均为化合物。A是淡黄色固体,C、D、E均属于盐类,D→E→C是我国化学家发明的经典工业制备C的方法。则A的电子式为___________;D→E的化学方程式为:____________________________________。
(4)若A为单质,C、D的相对分子质量相差16,B、E发生反应只生成一种产物,且属于盐类。则B→C的化学方程式为____________________________,E→C_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com