
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
分析 在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,存在沉淀溶解平衡,BaSO4(s)?Ba2++SO42-;若以Ksp表示BaSO4的溶度积,则Ksp=c(Ba2+)•c(SO42-),饱和溶液中c(Ba2+)=c(SO42-),加入氯化钡溶液增大钡离子浓度,沉淀溶解平衡向生成沉淀的方向进行,硫酸根离子浓度减小,溶度积常数随温度变化,不随浓度改变.
解答 解:A、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,故A错误;
B、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,温度不变,溶液中的溶度积常数不变,故B错误;
C、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,钡离子浓度大于硫酸根离子浓度,溶液中的溶度积常数不变,故C正确;
D、溶度积常数是随温度变化不随浓度改变,最后溶液中的溶度积常数不变,钡离子浓度大于硫酸根离子浓度,故D错误;故选C.
点评 本题考查了沉淀溶解平衡的建立和影响因素判断,注意溶度积随温度变化是分析解题关键,题目较简单.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
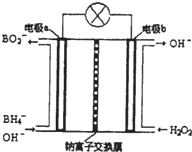 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═H2O+CO2↑ BaCO3+2HCl═BaCl2+H2O+CO2↑ | |
| C. | Ca2++CO32-═CaCO3↓ Ca(OH)2+K2CO3═CaCO3↓+2KOH | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com