
| A. | 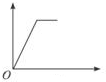 | B. | 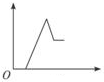 | C. | 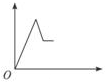 | D. | 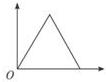 |
分析 开始发生反应:H++OH-=H2O,没有沉淀生成,氢离子反应完毕,再发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀达最大值时,再加入NaOH溶液,又发生反应:Al(OH)3+OH-=AlO2-+2H2O,最终得到沉淀为Mg(OH)2.
解答 解:开始发生反应:H++OH-=H2O,没有沉淀生成,氢离子反应完毕,再发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀达最大值时,再加入NaOH溶液,又发生反应:Al(OH)3+OH-=AlO2-+2H2O,最终得到沉淀为Mg(OH)2,故消耗氢氧化钠溶液的体积(x轴)和生成沉淀量(y轴)之间的函数关系为: ,
,
故选:B.
点评 本题以图象形式考查Mg、Al化合物性质,明确发生的反应即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③⑥ | C. | ③⑤⑥ | D. | ①②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
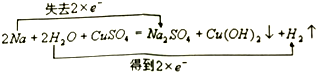 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 光导纤维中成分和沙子中的主要成分相同 | |
| C. | 用通入澄清石灰水的方法可以区分出CO2和SO2气体 | |
| D. | SO2的漂白原理与木炭、过氧化钠及湿润氯气的漂白原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com