
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
分析 A.压强增大后,平衡向着逆向移动,二氧化碳的浓度小于原先的2倍;
B.反应中生成气体、反应中气体系数增大的反应都是熵增大的过程;
C.反应中气体始终为二氧化碳,所以气体的密度一定不变;
D.容器的容积不变,充入稀有气体后气体的浓度不变,则平衡不移动.
解答 解:A.将体积缩小为原来的一半,当体系再次达到平衡时,若平衡不移动,C02的浓度为原来的2倍,由于压强增大,平衡向着逆向移动,则平衡时二氧化碳的浓度小于原先的2倍,故A错误;
B.CaCO3(s)高温分解为CaO(s)和CO2(g),反应方程式为:CaCO3(s)$\frac{\underline{\;\;△\;\;}}{\;}$CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,则△S>0,故B错误;
C.该反应中只有二氧化碳气体,所以反应过程中气体的密度始终不变,则将体积增大为原来的2倍,再次达到平衡时,气体密度不变,故C正确;
D.保持容器体积不变,充入He,由于气体的浓度不变,则平衡不会移动,故D错误;
故选C.
点评 本题考查了化学平衡及其影响,题目难度中等,明确影响化学平衡的因素为解答关键,C为易错点,注意无论平衡是否移动,反应中只有二氧化碳一种气体,为易错点.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
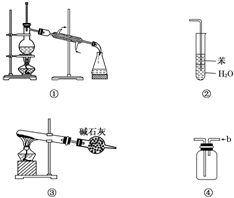
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气可收集H2、NO等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
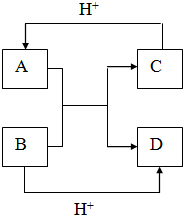 写出下列微粒的化学式
写出下列微粒的化学式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
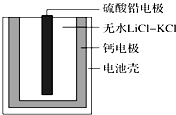 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 常温时,在正负极间接上电流表或检流计,指针发生偏转 | |
| D. | 每转移0.1 mol电子,理论上生成10.35g Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
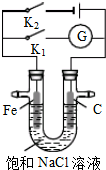
| A. | 只闭合K1,电流计G指针不发生偏转 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐降低 | |
| C. | 只闭合K2,电路中通过0.1mol电子时,两极共产生2.24L气体 | |
| D. | 只闭合K2,铁棒上发生的反应为:2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com