
| A. | 石英玻璃具有固定的熔点 | |
| B. | 石英玻璃的结构类似于液体 | |
| C. | 石英玻璃耐高温且能抵抗一切酸的腐蚀 | |
| D. | 石英玻璃能经受温度剧变且能抵抗碱的腐蚀 |
分析 A.只有纯净物才有固定的熔沸点;
B.玻璃是介于结晶态和无定形态之间的一种物质状态,叫做玻璃态.玻璃态物质没有固定的熔点,它会在一定的温度段内变软,并且温度不断地升高,最后在温度的不断变化中全部变成液态;
C.二氧化硅能够与氢氟酸反应;
D.二氧化硅为酸性氧化物,能够与氢氧化钠反应.
解答 解:A.石英玻璃为混合物,不具有固定熔沸点,故A错误;
B.玻璃是介于结晶态和无定形态之间的一种物质状态,叫做玻璃态.玻璃态物质没有固定的熔点,它会在一定的温度段内变软,并且温度不断地升高,最后在温度的不断变化中全部变成液态,故B正确;
C.石英玻璃可与氢氟酸反应SiO2+4HF=SiF4↑+2H2O,所以石英玻璃能够被氢氟酸腐蚀,故C错误;
D.SiO2是酸性氧化物,可与强碱反应,SiO2+2NaOHNa2SiO3+H2O,所以石英玻璃不耐碱腐蚀,故D错误;
故选:B.
点评 本题考查了石英玻璃的性质,明确石英玻璃主要成分是二氧化硅,熟悉二氧化硅的性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
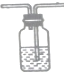
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 其钠盐的化学式为Na2X | B. | X是金属元素 | ||
| C. | 其最高价氧化物的水化物为强酸 | D. | 其最高价氧化物为XO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
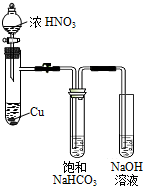 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
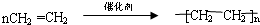 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2YZ4 | B. | XY2Z3 | C. | X3YZ4 | D. | XYZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
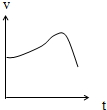 氯酸钾和亚硫酸氢钠发生氧化还原反应生成-1价的氯和+6价的硫 的速率如图所示,已知这个反应的速率除了与反应物浓度有关外,还随着溶液中c(H+)增大而加快
氯酸钾和亚硫酸氢钠发生氧化还原反应生成-1价的氯和+6价的硫 的速率如图所示,已知这个反应的速率除了与反应物浓度有关外,还随着溶液中c(H+)增大而加快查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、Al3+、H+ | B. | Na+ | ||
| C. | Na+、Fe3+ | D. | Na+、Fe2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com