
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
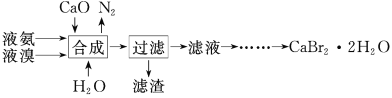
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):
![]()
使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
【答案】打开玻璃塞,将上层液体从上口倒入另一烧杯中 3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O 温度过高,Br2、NH3易挥发 使NH3稍过量,确保Br2被充分还原 Ca(OH)2 将滤液蒸发浓缩、冷却结晶、过滤、用乙醇洗涤干净后,在真空干燥箱中干燥(或低温干燥,或用滤纸吸干)
【解析】
制备溴化钙晶体的工艺流程:将液氨、液溴、CaO与水混合发生反应3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O、CaO+H2O=Ca(OH)2,过滤,滤渣为Ca(OH)2,滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr22H2O晶体,据此分析作答。
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是:使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,将上层液体从上口倒入另一烧杯中;
(2)在“合成”中为液氨、液溴、CaO发生反应:3CaO+3Br2+2NH3=3CaBr2+N2↑+3H2O;其中液溴、液氨易挥发,所以合成过程温度不能过高;投料时控制n(Br2)∶n(NH3)=1∶0.8,确保Br2被充分还原;
(3)合成反应中:CaO+H2O=Ca(OH)2,故滤渣为Ca(OH)2;
(4)滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr22H2O晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒温密闭容器中发生反应![]() ;经2min,B的浓度减少
;经2min,B的浓度减少![]() 。对此反应的下列表述不正确的是( )
。对此反应的下列表述不正确的是( )
A.用A表示的反应速率是![]()
B.用B表示的反应速率是![]()
C.在2min末时,容器内压强不变
D.在这2min内C和D两物质浓度都逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。

(已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ·mol-1。)请回答下列问题:
(1)图中A、C分别表示____、____,E的大小对该反应的反应热____(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“变大”、“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式____。
(4)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的ΔH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A(g)+B(g)xC(g),符合图(I)所示关系,由此推断对图(II)的说法正确的是
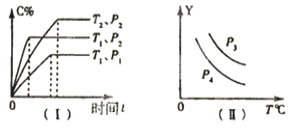
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示C的质量分数
C.P3>P4,Y轴表示混合气体密度
D.P3<P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、装置、操作或结论的描述正确的是( )
A.图反应一段时间后试管中液面会下降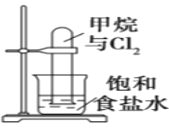
B.图装置可用于分离乙醇和乙酸乙酯的混合液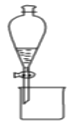
C.图装置可用于实验室制乙炔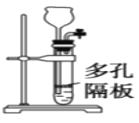
D.图教材重结晶法提纯苯甲酸的实验中,主要步骤依次为:加热溶解→趁热过滤→冷却结晶→过滤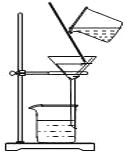
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com