
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |

| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析 (1)二价铁具有较强的还原性,在制备碳酸亚铁的过程中,要防止二价铁被氧化,二价铁离子与碳酸氢根离子反应生成碳酸铁沉淀;
(2)①防止挥发的HCl干扰后面的实验,故需除去,可选用饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,故硬关闭止水夹b,打开止水夹a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒计算,产率=$\frac{实际产量}{理论产量}$;
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量.
解答 解:(1)二价铁具有较强的还原性,在制备碳酸亚铁的过程中,为了防止二价铁被氧化,需加入少量铁粉,绿矾的水溶液与NH4HCO3溶液反应的方程式为 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:防止二价铁被氧化;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)①由于稀盐酸与石灰质制备二氧化碳的过程中,HCl有挥发性,为了避免挥发出的HCl干扰后续试验,故需除去,可选用饱和NaHCO3溶液,
故答案为:饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,此过程不需要二氧化碳,需要控制左侧的物质不能进入右侧的反应装置,故硬关闭止水夹b,打开止水夹a,故答案为:b;a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽,若产生沉淀则需要继续除空气,以免对实验造成干扰,
故答案为:判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化,故答案为:H+会与NH2CH2COOH反应;bc;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度,
故答案为:降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒知理论上产生[(NH2 CH2COO)2 Fe0.10mol,其质量为20.4g,故产率=$\frac{实际产量}{理论产量}$=$\frac{m}{20.4}$,故答案为:$\frac{m}{20.4}$;
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量,
故答案为:称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
点评 本题考查实验制备方案,涉及化学反应基本原理、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,题目难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
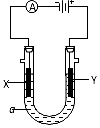 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com