
【题目】下列方法中,不能用于实验室制取氨的是( )
A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B.加热试管中的氯化铵固体
C.将烧瓶中的浓氨水加热
D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
【答案】B
【解析】A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热,发生反应:Ca(OH)2+2NH4Cl ![]() 2NH3↑+2H2O+CaCl2 , 可用于制取氨气;A不符合题意;
2NH3↑+2H2O+CaCl2 , 可用于制取氨气;A不符合题意;
B.加热试管中的氯化铵固体,NH4Cl ![]() NH3↑+HCl↑,二者遇冷会重新化合形成NH4Cl固体,因此不能用于制取氨气,B符合题意;
NH3↑+HCl↑,二者遇冷会重新化合形成NH4Cl固体,因此不能用于制取氨气,B符合题意;
C.在氨水中存在平衡:NH3H2O ![]() NH3+H2O,若将烧瓶中的浓氨水加热,氨气从溶液中逸出,平衡正向移动,产生更多的氨气,因此可以用于实验室制取氨气,C不符合题意;
NH3+H2O,若将烧瓶中的浓氨水加热,氨气从溶液中逸出,平衡正向移动,产生更多的氨气,因此可以用于实验室制取氨气,C不符合题意;
D.在氨水中存在电离平衡:NH3+H2O ![]() NH3H2O
NH3H2O ![]() NH4++OH- , 当将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中,CaO与水发生反应产生Ca(OH)2 , 电离产生的OH-使溶液中c(OH-)增大,平衡逆向移动,NH3H2O分解产生氨气。而且CaO溶解使物质温度升高,加快了NH3H2O分解,因此有利于实验室制取氨气,D不符合题意;
NH4++OH- , 当将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中,CaO与水发生反应产生Ca(OH)2 , 电离产生的OH-使溶液中c(OH-)增大,平衡逆向移动,NH3H2O分解产生氨气。而且CaO溶解使物质温度升高,加快了NH3H2O分解,因此有利于实验室制取氨气,D不符合题意;
所以答案是:B
【考点精析】通过灵活运用氨的实验室制法,掌握安验室制法:用铵盐与碱共热,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O即可以解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于 , 即(填计算式);Na+的个数等于 , 即(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1 , 食盐晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( ) 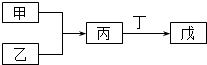
A.若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体.其结构如图:有关说法正确的是________ .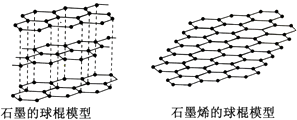
A.固态时,碳的各种单质的晶体类型相同
B.石墨烯中含有非极性共价键
C.从石墨中剥离石墨烯需要破坏化学键
D.石墨烯具有导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上〔如右图中的小立方体〕。请问图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D4种元素,A元素的气态氢化物分子式为AH4 , 其中A的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称为 , 其晶体类型是。
(2)B的氢化物的电子式为 , 属分子(填“极性”或“非极性”)。
(3)A和B形成化合物的分子空间构型为 , 属分子,其晶体类型是 , 俗名。
(4)C元素位于周期表中第周期族,A、C、D三种元素的最高价氧化物的水化物按酸性由强到弱的顺序排列为(用分子式表示)。
(5)C和D的化合物溶于水后滴入过量KOH,现象是 , 离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167kJ·mol-1。请回答下列问题:
(1)N60分子组成的晶体为晶体,其熔、沸点比N2(填“高”或“低”),原因是。
(2)1molN60分解成N2时吸收或放出的热量是kJ(已知N≡N键的键能为942kJ·mol-1),表明稳定性N60(填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种):。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质. 已知:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJmol﹣1
②C和C0的燃烧热(△H)分别为﹣393.5kJmol﹣1和﹣283kJmol﹣1
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=kJmol﹣1
(2)将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示. ①CO在0﹣9min内的平均反应速率v(CO)=molL﹣1min﹣1(保留两位有效数字);第12min时改变的反应条件可能为 .
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24min时达到平衡状态,CO2的体积分数为(保留三位有效数字),化学平衡常数K=(保留两位有效数字).
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2 . 已知常温下0.1molL﹣1的HCOONa溶液pH=10,则HCOOH的电离常数Ka= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com