
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
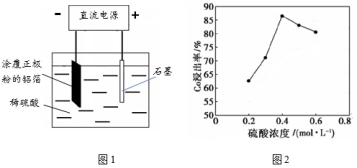
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式: 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4 )]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于 g。
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;
(2)写出A、B、C形成的化合物M的电子式________;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用________来解释。
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:________。
(5)D单质与M的水溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:选择题
日本福岛核电站的核原料铀?235(235 92U)裂变释放出具有放射性的碘?131(I)和铯?137(Cs),下列说法正确的是
A.127I与131I互为同素异形体 B.137Cs的核电荷数为137
C.铀?235的中子数是143 D.铯与水的反应比钠与水的反应缓慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A.用米汤检验食用加碘盐(含KIO3)中含有碘元素
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验汽油中是否含有不饱和烃
D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
飓风“桑迪”,是由于气候变暖而形成于大西洋洋面上的一级飓风。2012年10月30日上午6点45分,飓风“桑迪”在新泽西州登陆,截至11月4日上午,已导致美国113人死亡,联合国总部受损。下列与飓风“桑迪” 的形成关系最为密切的是
A.NO2 B.SO2 C.CO2 D.CO
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点。其中一种镁电池的反应原理为:xMg+ Mo3S4 MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A.放电时Mo3S4发生氧化反应
B.放电时,正极反应式为:Mo3S4 + 2xe- = Mo3S42x-
C.充电时,电路中通过2mol电子时,可消耗1mol Mg
D.充电时,Mg2+向负极移动
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练一理综化学试卷(解析版) 题型:填空题
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量。
Ⅰ.CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应②:CO2(g)+H2(g)  CO (g)+H2O(g)△H2
CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)  CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
(1)反应②的△H2= ,反应 ① 自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)某温度下,在体积为2 L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①。一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示。
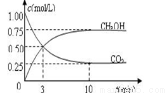
①前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为
(结果保留两位小数) 。
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
E.再充入1 mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡
(填“正向”、“逆向”或“不”)移动。
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4)。氨基甲酸铵极易发生:H2NCOONH4+2H2O  NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下期中化学试卷(解析版) 题型:选择题
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )
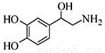
A.每个去甲肾上腺素分子中含有3个酚羟基
B.每个去甲肾上腺素分子中含有1个手性碳原子
C.1mol去甲肾上腺素最多与2mol Br2发生取代反应
D.去甲肾上腺素不能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
现有M、X、A、E4种元素的单质,能发生以下反应
①在水溶液中,M+X2+=M2++X
②A+2H2O(冷)===A(OH)2+H2↑
③X、E相连浸入稀H2SO4中,电极反应为:X-2e-=X2+,2H++2e-=H2↑
判断它们的还原性由强到弱的顺序是( )
A.M、X、A、E B.A、M、X、E C.M、X、E、A D.E、A、M、X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com