
 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题.
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题. ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应.分析 (1)乙烯是含有碳碳双键的最简单的烯烃,根据电子式可以书写结构简式;
(2)乙烯可以和水加成生成乙醇,乙醇可以被氧化为乙醛,乙醛易被氧化为乙酸;乙烯可以发生加聚反应生成聚乙烯;
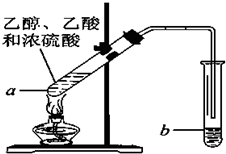
(3)乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,属于酯化反应;制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;乙酸乙酯不溶于饱和碳酸钠溶液.
解答 解:(1)乙烯中含碳和碳之间以共价双键结合,电子式为 ,根据电子式可以书写结构简式为H2C=CH2,
,根据电子式可以书写结构简式为H2C=CH2,
故答案为: ;H2C=CH2;
;H2C=CH2;
(2)(4)乙烯可以和水加成生成乙醇,所以A是乙醇,乙醇可以被氧化为B乙醛,乙醛易被氧化为C乙酸,乙醇的催化氧化反应为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,反应为氧化反应;乙烯可以发生加聚反应生成聚乙烯,反应为: ,属于加聚反应,
,属于加聚反应,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O;氧化反应; ;加聚反应;
;加聚反应;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH3COOH+C2H5OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,反应为酯化反应,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层.乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$ CH3COOC2H5+H2O;酯化反应;饱和碳酸钠溶液;吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;分液.
点评 本题考查乙烯的化学性质、制备方案的设计,题目难度不大,明确酯化反应原理为解答关键,注意掌握酯化反应中浓硫酸、饱和碳酸钠溶液溶液的作用,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
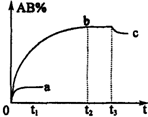 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com