
| A. | NX2一定不与酸反应 | |
| B. | R2与水反应时,水是还原剂 | |
| C. | 简单离子的半径:M<Z<X | |
| D. | 最高价氧化物对应水化物的碱性:Z<M |
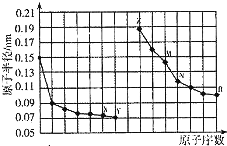
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,故A错误;
B.R2(即Cl2)与水反应时,Cl2是氧化剂又是还原剂,故B错误;
C.离子电子层结构相同,核电荷数越大离子半径越小,故C正确;
D.X、N两种元素组成的化合物为二氧化硅,可与HF酸反应,故D错误.
故选C.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
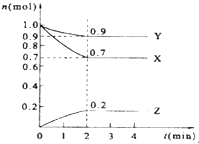 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
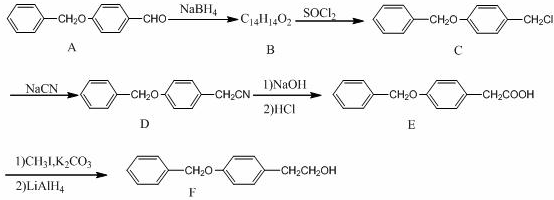
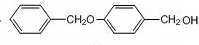 ;由B→C的反应类型是:取代反应.
;由B→C的反应类型是:取代反应. .
. .
.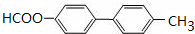 .
. ,请写出以
,请写出以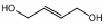 为原料制备化合物X
为原料制备化合物X 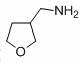 (结构简式见图)的合成路线流程图(无机试剂可任选):
(结构简式见图)的合成路线流程图(无机试剂可任选): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| Y | ||||
| Q | W | X | Z |
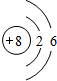 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.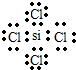 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
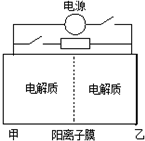 如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )| A. | 放电过程,甲池发生氧化反应 | |
| B. | 放电过程,电池反应:2S22-+Br3-=S42-+3Br- | |
| C. | 充电过程,乙池为阳极室 | |
| D. | 充电过程,当阳极室阴离子增加了2mol,整个电路中电子转移2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造普通玻璃的原料是纯碱、石灰石和石英 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 二氧化硫有漂白性,可以使蓝色石蕊试纸褪色 | |
| D. | 漂白精、臭氧和活性炭都能用于游泳池的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
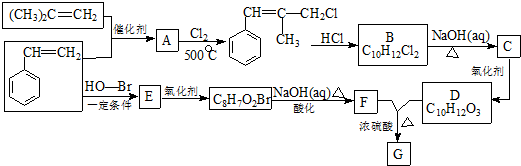
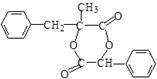 .
.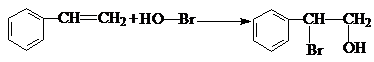 .
.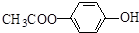 和
和 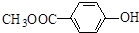 .
.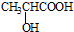 )的合成线路:
)的合成线路:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com