
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成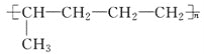 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 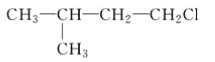 B.
B. 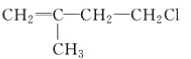 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 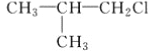
【答案】C
【解析】
先根据高聚物![]() 的结构简式判断其合成单体,从而找出C的结构简式,然后根据与硝酸银溶液反应生成白色沉淀判断卤代烃的类型,最后根据醇的消去反应原理判断A的结构简式。
的结构简式判断其合成单体,从而找出C的结构简式,然后根据与硝酸银溶液反应生成白色沉淀判断卤代烃的类型,最后根据醇的消去反应原理判断A的结构简式。
高聚物![]() 的单体是:CH2=CH2和CH3-CH=CH2,因此C为CH3-CH=CH2,在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,D中含有Cl-,因此应选能发生消去反应且生成丙烯的氯代烃,
的单体是:CH2=CH2和CH3-CH=CH2,因此C为CH3-CH=CH2,在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,D中含有Cl-,因此应选能发生消去反应且生成丙烯的氯代烃,
A.![]() 发生消去反应生成的是:(CH3)2CH2CH=CH2,生成的不是丙烯,选项A错误;B.
发生消去反应生成的是:(CH3)2CH2CH=CH2,生成的不是丙烯,选项A错误;B.![]() 发生消去反应生成的是:2-甲基-1,3-丁二烯,不是丙烯,选项B错误;C.CH3-CH2-CH2Cl发生消去反应生成的是CH3-CH=CH2,选项C正确;D.
发生消去反应生成的是:2-甲基-1,3-丁二烯,不是丙烯,选项B错误;C.CH3-CH2-CH2Cl发生消去反应生成的是CH3-CH=CH2,选项C正确;D.![]() 发生消去反应生成的是:(CH3)2CH=CH2,不是丙烯,选项D错误;答案选C。
发生消去反应生成的是:(CH3)2CH=CH2,不是丙烯,选项D错误;答案选C。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了_________________。
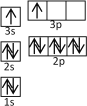
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为______。
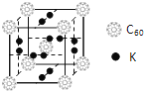
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是
A. 2CH4(g)4O2(g)=2CO2(g)+4H2O(l)△H═+89 kJ/mol
B. CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═﹣890 kJ/mol
D. ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l)△H═﹣890 kJ/mol
CO2(g)+H2O(l)△H═﹣890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
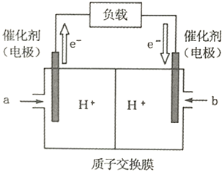
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A. 甲酸与乙二酸互为同系物
B. 乙烯和乙烷可用溴的四氯化碳溶液鉴别
C. 分子式为C4H10O且可与金属钠反应放出氢气的有机化合物有6种
D. 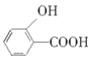 (水杨酸)与足量的NaHCO3溶液反应可生成
(水杨酸)与足量的NaHCO3溶液反应可生成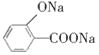 、CO2和H2O
、CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为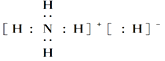
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对日益加剧的能源危机,我国《能源发展纲要》中倡导大力发展替代能源,如风能、电能等,要大力开发电动自行车、电动摩托车、电动汽车。回答下列问题:
(1)下列物质中可以作为燃料电池的负极反应物的是(____)
A.CH4 B.H2 C.C2H5OH D.CO2
(2)若用CH4作燃料,氢氧化钾溶液作电解质溶液,写出负极上的电极反应式_______________。
(3)电池工作时,溶液中KOH的物质的量浓度________(填“增大”“不变”或“减小”)。
(4)某温度下的饱和Na2SO4溶液的溶解度为25 g,用甲烷燃料电池进行电解,当阳极产生3.36 L(标准状况)气体时,电路中通过电子的物质的量为_______,消耗甲烷的物质的量为_______,此时,析出Na2SO4·10H2O的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可用如图制备乙炔,回答下列问题
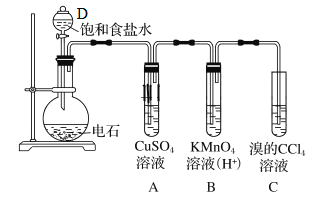
(1)仪器D名称_______________________。
(2)制取乙炔的化学方程式_______________________________________________。
(3)试管A观察到的现象_______________________。
(4)写出C发生的化学方程式______________________________________________。
(5)若没有A装置,观察到B褪色,且有浅黄色浑浊,请写出生成浅黄色浑浊的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com