
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.标况下,22.4LS O3含氧原子数为3NA
B.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-) =2NA
C.2 molSO2和1 molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上第一次大考化学卷(解析版) 题型:选择题
X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上开学考试化学试卷(解析版) 题型:选择题
下列溶液中的Cl-浓度与150 mL、1mol·L-1MgCl2溶液中的Cl-浓度相等的是( )
A.300 mL、1mol·L-1NaCl溶液 B.75 mL、2mol·L-1CaCl2溶液
C.150 mL、2mol·L-1KCl溶液 D.75 mL、1mol·L-1AlCl3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g)  2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化 率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1
B.若向容器中充入氦气,压强增大,Y的转化率提高
C.升高温度,正反应速率减小,平衡向逆反应方向移动
D.开始充入容器中的X、Y物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
已知①2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,
②2H2(g)+O2(g)==2H2O(g)△H=-483.6kJ/mol,
则制备水煤气的反应C(S)+H2O(g)==CO(g)+H2(g)的△H为
A、+262.6 kJ/mol B、-131.3kJ/mol C、-352.kJ/mol D
kJ/mol B、-131.3kJ/mol C、-352.kJ/mol D 、+131.3kJ/mol
、+131.3kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上第一次月考化学卷(解析版) 题型:填空题
钠、氯及其化合物有如下转化关系,请按要求填空:
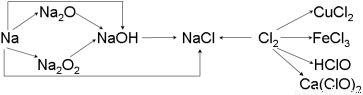
(1)金属钠的密度比水 ,实验室中金属钠通常保存 在 中。一小块金属钠投入水中的反应方程式是 。
在 中。一小块金属钠投入水中的反应方程式是 。
(2)Na2O2 是  色的固体,Na2O2 的重要用途是 ,有关反应的化学方程式为 。
色的固体,Na2O2 的重要用途是 ,有关反应的化学方程式为 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 。
(4)漂白粉的有效成份是 (填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上第一次月考化学卷(解析版) 题型:选择题
右图是一种试验某气体化学性质的实验装置。在A处通入氯气,图中B为开关,关闭B时,C中红色布条颜色无变化;打开B时,C处红色布条颜色褪去。由此做出的判断正确的是
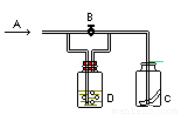
A.D中可以是水 B.D中可以是饱和食盐水
C.D中不可能是浓H2SO4 D.通入的氯气中含有水蒸气
查看答案和解析>>
科目:高中化学 来源:2017届山东省新泰市高三上学期第一次阶段考化学试卷(解析版) 题型:填空题
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:步骤一,利用NaClO3在硫酸作用下与SO2反应生成 ClO2和一种酸式盐。步骤二,将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
回答下列问题:
(1)NaClO2中Cl的化合价为_____________。
(2)写出步骤一中生成ClO2的化学方程式____________________
(3) 步骤二反应中氧化剂与还原剂的物质的量之比为_________________,该反应中氧化产物是____________________。
(4)亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为______________。
(5)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(6)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com