
【题目】回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
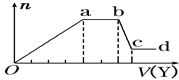
则X中一定含有的阳离子是_________,bc段反应的离子方程式为________。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
离子 | Mg2+ | Al3+ | SO42 | Cl |
c/(mol/L) | 0.5×102 | 1.0×102 | 0.5×102 | 3.0×102 |
向该溶液中逐滴加入0.5 molL-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____mL。
【答案】干沙土 c d 2MgO2+4H+=2Mg2++2H2O+O2↑ Al3+、Mg2+、NH4+ Al(OH)3+OH-=AlO2-+2H2O 100
【解析】
(1)金属钠等活泼金属着火时,应该用干沙土来灭火;钠与水反应生成H2,钠熔点低,熔化成小球并在液面上游动,钠消耗水,使石灰水处于过饱和状态,溶液变浑浊;
(2)可结合Na2CO3和NaHCO3性质做相应判断;
(3)过氧化镁与胃酸反应类比过氧化钠与胃酸反应;
(4)oa段生成Mg(OH) 2 和Al(OH)3沉淀、ab段是NH4+与OH-反应,bc段是Al(OH)3的溶解,cd段剩余的沉淀是Mg(OH) 2;
(5)Mg2+结合OH-生成Mg(OH) 2,Al3+结合OH-生成AlO2-,据此计算。
(1)金属钠可与水反应,金属钠等活泼金属着火时,应该用干沙土来灭火;金属钠与水反应放出大量的热,将其熔化成闪亮的小球,与水接触的部位产生的气体不均匀推动小球在液面上游动;随着反应的进行,水量不断减少,且氢氧化钙溶解度随温度升高而降低,因此有部分氢氧化钙析出,使溶液变浑浊,但它不是银白色物质,综上,c错误;
(2)a.常温下,Na2CO3在水中的溶解度比NaHCO3大,故a错误;b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,相对分子质量NaHCO3小于Na2CO3,所以等质量的NaHCO3、Na2CO3的物质的量n (NaHCO3)>n (Na2CO3),即在相同条件下产生CO2的体积NaHCO3多,故b错误;c.Ca(OH)2溶液与Na2CO3溶液反应产生白色沉淀,Ca(OH)2溶液与和NaHCO3溶液反应也产生白色沉淀,故无法鉴别,c错误;d.CO2与Na2CO3和水反应生成NaHCO3,故NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2,d正确;综上,本题选d。
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁与胃酸反应类比过氧化钠与胃酸反应,故离子反应方程式为2MgO2+4H+=2Mg2++2H2O+O2↑;
(4)无色稀溶液肯定不含Fe3+,bc段沉淀减少,则bc段是Al(OH)3的溶解,cd段显示的是Mg(OH) 2,原溶液中一定有Al3+、Mg2+,ab段沉淀量不变,发生反应NH4++ OH-=NH3H2O,故原溶液中一定有NH4+。综上,含有的离子为Al3+、Mg2+、NH4+;bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(5)Mg2+最终存在形式为Mg(OH) 2,Al3+最终存在形式为AlO2-,1L溶液中含有Mg2+0.005mol,Al3+0.01mol。Mg2+消耗OH- 0.01mol,Al3+消耗OH- 0.04mol,共消耗NaOH溶液0.05mol,V[NaOH(aq)]=n/c=0.05mol/0.5 molL-1=0.1L=100mL,故消耗NaOH体积为100 mL。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaC1O2)是重要漂白剂,探究小组开展如下实验。
实验I:用如图装置制取NaClO2。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaC1。
(1)检查整套装置气密性的操作是:首先____________,打开K1、K2,然后向A、E中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若A、E处有气泡,停止加热,一段时间后,A、E干燥管内形成一段稳定的水柱,说明整套装置气密性良好。
(2)用50%双氧水配制30%H2O2溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要的仪器有________________ (填仪器名称)。
(3)装置C的作用是____________________________。
(4)己知装置B中的产物有C1O2气体,则装置D中反应生成NaClO2的化学方程式为________________________________________________。
(5)请补充完整从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;
②____________________;
③38℃~60℃热水洗涤;
④低于60℃干燥得到成品。
(6)实验结束时,打开K1,关闭K2,装置A的作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消去反应是有机合成中引入不饱和键的常见途径,大部分卤代烃和醇都有这一性质。
(1)一定条件下部分卤代烃脱卤化氢或醇脱水后,相应产物及其产率如下表:
卤代烃或醇 | 相应产物及其产率 |
|
81% 19% |
|
80% 20% |
|
80% 20% |
|
90% 10% |
分析表中数据,得到卤代烃和醇发生消去反应时脱氢位置倾向的主要结论是_________。
(2)列举一个不能发生消去反应的醇,写出结构简式:_______________________________。
(3)已知在浓硫酸的作用下脱水,生成物有顺-2-戊烯(占25%)和反-2-戊烯(占75%)两种。写出2-戊烯的顺式结构:_______________________________。
(4)以下是由2-溴戊烷合成炔烃C的反应流程:
![]()
A的结构简式为_________________,C的结构简式为___________________,流程中的反应属于消去反应的是___________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家最近发现了一种新原子,它的原子核内有162个中子,质量数274,该元素的核电荷数为( )
A. 112 B. 161 C. 272 D. 433
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中亚硫酸表现的性质,其中一种与另外三种不同的是( )
A.能使酸性高锰酸钾褪色B.在空气中易被氧化变质
C.能使溴水褪色D.在溶液中加入氢氧化钡溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿。下列叙述正确的是
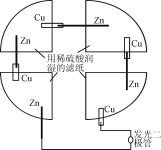
A. 锌片为正极
B. 锌片上有气泡,铜片溶解
C. 电流都是从铜片经外电路流向锌片
D. 该装置至少有两种形式的能量转换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)下列说法不正确的是

A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A是一种金属单质,则反应①②③均可为化合反应,反应④可为置换反应
C. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液PH<7,则将C通入A溶液中,pH先减小后增大
D. 若A、B、C是三种不同类别的固体物质,则B可以是工业上制取A、C的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。
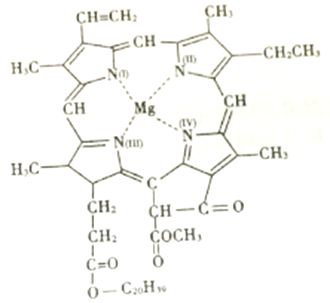
①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。
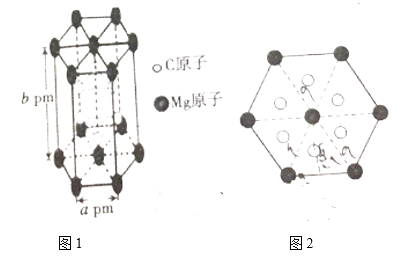
①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com