
 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.分析 (1)反应中碘元素由+5价降低为0价,硫元素由+4升高为+6价,依据得失电子守恒及原子个数守恒写出反应方程式;
氧化还原反应中,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂;
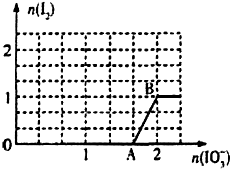
(2)①根据图象可知0~A段发生IO3-+3HSO3-═3SO42-+I-+3H+,AB段曲线发生IO3-+5I-+6H+═3H2O+3I2;
②设需要加入NaIO3为x,依据IO3-+3HSO3-═3SO42-+I-+3H+,IO3-+5I-+6H+═3H2O+3I2计算解答.
解答 解:(1)反应中碘元素由+5价降低为0价,硫元素由+4升高为+6价,要使得失电子守恒,NalO3系数为4,
NaHSO3系数为10,依据原子个数守恒该反应的方程式为:4NaIO3 +10NaHSO3 =7Na2SO4 +3H2SO4 +2I2+2H2O,用单线桥表示为: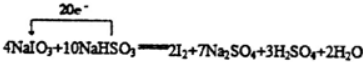 ;
;
反应中亚硫酸氢钠中硫元素化合价升高,为还原剂;碘酸钾中碘元素化合价降低,碘酸钾做氧化剂,碘元素被还原;
故答案为:4;10;2;7;3;2;NaHSO3;碘;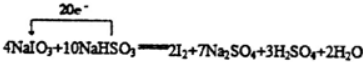 ;
;
(2)①根据图象可知0~A段发生IO3-+3HSO3-═3SO42-+I-+3H+,AB段曲线发生IO3-+5I-+6H+═3H2O+3I2;
故答案为:IO3-+5I-+6H+═3H2O+3I2;
②设需要加入NaIO3为x,
IO3-+3HSO3-═3SO42-+I-+3H+,
1 3 1
$\frac{5}{3}$ 5 $\frac{5}{3}$
IO3-+5I-+6H+═3H2O+3I2
1 5 3
(x-$\frac{5}{3}$)5(x-$\frac{5}{3}$) 3(x-$\frac{5}{3}$)
则:$\frac{n({I}^{-})}{n({I}_{2})}$=$\frac{\frac{5}{3}-5(x-\frac{5}{3})}{3(x-\frac{5}{3})}$=a;
解得:x=$\frac{5a+10}{3a+5}$.
故答案为:$\frac{5a+10}{3a+5}$.
点评 本题考查了化学方程式的书写、有关方程式的计算,明确氧化还原反应得失电子规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
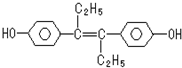
| A. | 该药物可以用有机溶剂萃取 | |
| B. | 可与NaOH反应但是不与Na2CO3发生反应 | |
| C. | 1mol该有机物不可以Br2发生取代反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60是一种新型化合物 | |
| B. | C60属于原子晶体 | |
| C. | C60在纯氧中燃烧只生成一种产物CO2 | |
| D. | C60的相对分子质量为720 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com