
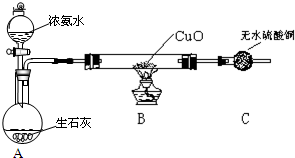
分析 (一)(1)实验室用氯化铵和消石灰反应制备氨气,反应生成氯化钙、氨气和水;
(二)(2)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥;
(3)由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(三)(4)根据Cu2O在酸性条件下不稳定的性质设计实验检验该红色物质中是否含有Cu2O;
(5)黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A,可知CuO分解生成Cu2O,由Cu原子守恒可知,n(Cu(OH)2)=$\frac{98g}{98g/mol}$=$\frac{72g}{144g/mol}$×2=1mol,即氢氧化铜分解生成CuO和水,CuO分解生成Cu2O和氧气.
解答 解:(一)(1)实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(二)(1)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,即:在装置A与B之间增加装有碱石灰的干燥管,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(2)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(三)(4)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
(5)黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A,可知CuO分解生成Cu2O,由Cu原子守恒可知,n(Cu(OH)2)=$\frac{98g}{98g/mol}$=$\frac{72g}{144g/mol}$×2=1mol,即氢氧化铜分解生成CuO和水,CuO分解生成Cu2O和氧气,则A为Cu2O,发生的反应为Cu(OH)2=CuO+H2O、4CuO=2Cu2O+O2,该实验结论为CuO比Cu2O的热稳定性差,
故答案为:Cu2O;Cu(OH)2=CuO+H2O、4CuO=2Cu2O+O2;CuO比Cu2O的热稳定性差.
点评 本题考查性质实验方案的设计,为高频考点,涉及氨气的制备及性质、Cu的化合物性质及检验实验设计等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有的OH-离子数目为0.2NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
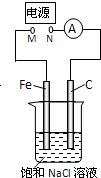
| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com