
乙二酸俗称草酸,为二元酸(结构简式为HOOC﹣COOH,可简写为H2C2O4).25℃时,草酸的电离平衡常数K1=5.0×10﹣2,K2=5.4×10﹣5;碳酸的电离平衡常数K1=4.5×10﹣7,K2=4.7×10﹣11.草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9.回答下列问题:
(1)写出水溶液中草酸的电离方程式: .
(2)25℃,物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH (填“大”“小”或“相等”).
(3)常温下将0.2mol/L的KOH溶液10mL与0.2mol/L的草酸溶液10mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序: .
(4)25℃时向20mL碳酸钙的饱和溶液中逐滴加入1.0×10﹣3 mol/L的草酸钾溶液20mL,能否产生沉淀? 否 (填“能”或“否”).
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式: ; .
| 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;离子浓度大小的比较. | |
| 分析: | (1)草酸是二元弱酸,分步电离; (2)相同条件下,酸的电离平衡常数越大,其电离程度越大,则酸根离子的水解程度越大,溶液的碱性越强; (3)将0.2mol/L的KOH容液10mL与0.2mol/L的草酸溶液10mL混合,恰好完全反应生成KHC2O4,结合溶液的酸碱性比较离子浓度大小; (4)根据c(Ca2+)•c (C2O42﹣)和Ksp(4.0×10﹣8)相对大小判断,如果c(Ca2+)•c (C2O42﹣)=<Ksp(4.0×10﹣8),则无沉淀生成; (5)水垢中含有的CaSO4,先用碳酸钠溶液处理,转化为 CaCO3,再和盐酸反应得到氯化钙、水以及二氧化碳. |
| 解答: | 解:(1)草酸是二元弱酸,在水溶液里存在两步电离,第一步电离程度大于第二步,其电离方程式分别为:H2C2O4⇌HC2O4﹣+H+、HC2O4﹣⇌C2O42﹣+H+, 故答案为:H2C2O4⇌HC2O4﹣+H+、HC2O4﹣⇌C2O42﹣+H+; (2)草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子,导致草酸钠的pH小于碳酸钠, 故答案为:小; (3)将0.2mol/L的KOH容液10mL与0.2mol/L的草酸溶液10mL混合,恰好完全反应生成KHC2O4,存在的离子是H+、HC2O4﹣、C2O42﹣、H2C2O4、OH﹣,若混合溶液显酸性,说明HC2O4﹣电离程度大于水解程度,则C2O42﹣>H2C2O4溶液还存在水的电离,则H+>C2O42﹣,离子浓度的顺序为:c(K+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣), 故答案为:c(K+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣); (4)碳酸钙溶液中钙离子浓度= 故答案为:否; (5)水垢中含有的CaSO4,先用碳酸钠溶液处理,转化为 CaCO3,转化的离子方程式是CaSO4(s)+CO32﹣ (aq)⇌CaCO3(s )+SO42﹣ (aq),CaCO3+2H+=Ca2++H2O+CO2↑, 故答案为:CaSO4+CO32﹣=CaCO3+SO42﹣;CaCO3+2H+=Ca2++H2O+CO2↑. |
| 点评: | 本题考查了弱电解质的电离、难溶物的溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,明确弱电解质电离特点及溶度积常数的运用是解本题关键,难度中等. |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
下列各组离子在指定的环境中能大量存在的是
A.pH=1的无色溶液中:SO42—、Cu2+、Na+、Cl—
B.能使石蕊试纸变蓝色的溶液中:Na+、K+、S2—、CO32—
C.加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3—
D.水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
38.取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
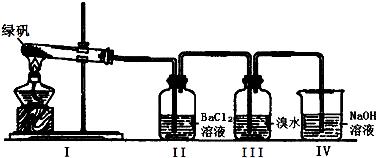
39. II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是 。
A.Fe2O3、SO3、H2O B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
40. III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是 。
41. NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式: 。
(三)探究FeSO4中Fe2+还原性:
42. 证明FeSO4有较强的还原性,完成下表。
| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
|
| 步骤二: |
|
(四)硫酸亚铁用途探究
43. 缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大城市今年夏季多次降下酸雨.据环保部门测定,该城市整个夏季酸雨的pH平均为3.2.在这种环境中的铁制品极易被腐蚀.对此条件下铁的腐蚀的叙述不正确的是( )
|
| A. | 此腐蚀过程有化学腐蚀也有电化学腐蚀 |
|
| B. | 发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═4OH﹣ |
|
| C. | 在化学腐蚀过程中有氢气产生 |
|
| D. | 发生电化学腐蚀时的负极反应为Fe﹣2e﹣═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中大量存在如下五种离子:NO3﹣、SO42﹣、Fe3+、H+、M,它们的物质的量之比依次为n(NO3﹣):n(SO42﹣):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是( )
|
| A. | Al3+ | B. | Mg2+ | C. | CO32﹣ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:NH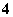 、K+、ClO-、Cl-
、K+、ClO-、Cl-
B.有SO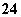 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH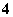 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.在[H+]=1.0×10-13 mol·L-1的溶液中:Na+、S2-、[Al(OH)4]-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某溶液中由水电离的[H+]=1×10-13 mol·L-1,该溶液可能是( )
①三氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
铁粉可与高温水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
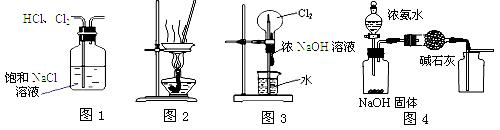
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置蒸发FeCl3溶液制备无水FeCl3
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取并收集干燥纯净的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com