

分析 ①碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,负极上是燃料发生失电子的氧化反应;
②根据燃料电池的总反应方程式判断pH的变化.
解答 解:①碱性甲烷燃料电池中通入甲烷的一极a为原电池的负极,该极上是燃料发生失电子的氧化反应,通入氧气的一极为原电池的正极,发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:a;O2+2H2O+4e-=4OH-;
②在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,电池工作一段时间后,由于氢氧根离子被消耗,所以电解质溶液的pH会减小,
故答案为:减小.
点评 本题综合考查了原电池的内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
 .
.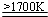 2AlN+3H2.
2AlN+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 相关平衡方程式 | |
| A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O?HClO+HCl |
| B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH-?Fe(OH)3 |
| C | 溶有CO2的正常雨水pH=5.6 | H2O+CO2?H2CO3?H++HCO3 |
| D | CaCO3固体溶于盐酸 | CaCO3(s)?Ca2+(aq)+CO32(aq) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
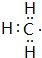 ,结构式为
,结构式为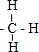 ;
;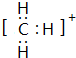 ,结构式为
,结构式为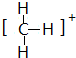 ;
;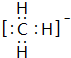 ,结构式为
,结构式为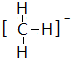 ;
;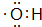 ,结构式为-O-H;
,结构式为-O-H;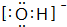 ,结构式为[O-H]-.
,结构式为[O-H]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+3H2SO4═3 H2↑+Fe2(SO4)3 | |
| B. | 铝与氧化铁反应 2Fe2O3+2Al$\frac{\underline{\;点燃\;}}{\;}$AL2O3+2Fe | |
| C. | 小苏打溶液与盐酸反应 NaHCO3+HCl═NaCl+CO2↑+H2O | |
| D. | 泡沫灭火器工作原理:6NaHCO3+Al2(SO4)3═3Na2SO4+2Al(OH)3↓+6 CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | |
| B. | 乙烯、乙烷、乙炔、丙烯 | |
| C. | 甲酸、乙醛、甲酸钠溶液、葡萄糖溶液 | |
| D. | 苯乙烯、苯酚、乙苯、甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com