
| A. | 上述反应在较高温度下才能自发进行 | |
| B. | 该反应的正反应活化能小于逆反应活化能 | |
| C. | 该反应中,断裂化学键的总键能大于形成化学键的总键能 | |
| D. | 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2 |
分析 A、根据△G=△H-T△S判断;
B、将赤热铂丝插入氨水中引发反应后铂丝保持红热状态,说明反应是放热反应;
C、放热反应中断裂化学键的总键能小于形成化学键的总键能;
D、若NH3和O2的混合气发生上述反应,气体通入足量水中,如果氧气过量则剩余气体是O2;如果氧气不足则剩余气体是NO.
解答 解:A、根据△G=△H-T△S,反应4NH3(g)+5O2(g)$?_{△}^{Pt}$4NO(g)+6H2O(g),△S>0,△H<0,所以△G<0,在任意条件下都能自发,故A错误;
B、将赤热铂丝插入氨水中引发反应后铂丝保持红热状态,说明反应是放热反应,所以该反应的正反应活化能小于逆反应活化能,故B正确;
C、放热反应中断裂化学键的总键能小于形成化学键的总键能,故C错误;
D、若NH3和O2的混合气发生上述反应,气体通入足量水中,如果氧气过量则剩余气体是O2;如果氧气不足则剩余气体是NO,所以不一定是一氧化氮,故D错误;
故选B.
点评 本题考查了反应焓变熵变的分析判断,反应自发进行的判断依据,题目较简单.


科目:高中化学 来源: 题型:解答题
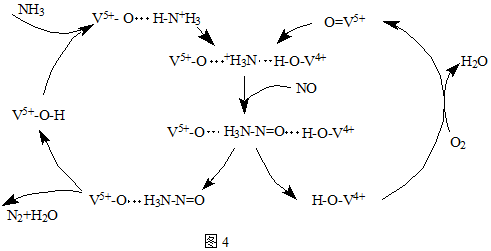
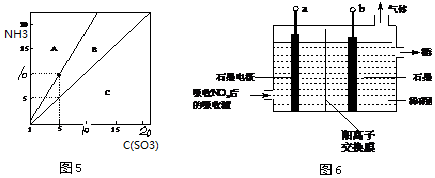
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
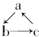 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Al2O3 | NaAlO2 | Al(OH)3 |
| 2 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 3 | MgCl2 | Mg(OH)2 | MgO |
| 4 | CuO | CuSO4 | Cu(OH)2 |
| 5 | Si | SiO2 | H2SiO3 |
| 6 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
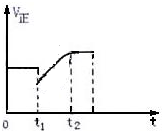 如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )| A. | t1时只减小了压强 | |
| B. | t1时只降低了温度 | |
| C. | t1时增加了SO2和O2的浓度,平衡向正反应方向移动 | |
| D. | t1时减小SO2浓度的同时,增加了SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 一定没有乙烯 | D. | 可能是甲烷和丁烯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com