



 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
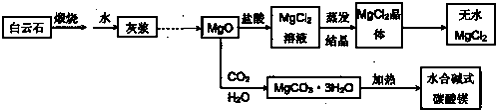
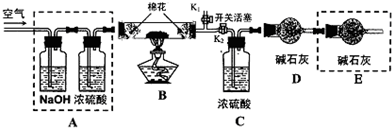
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CH4) |
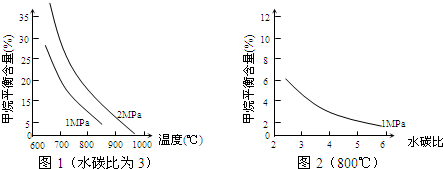
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取样,加入紫色石蕊,溶液变红,一定有H+ |
| B、取样,加入氯化钡溶液有白色沉淀产生.再加盐酸,沉淀不消失,一定有SO42- |
| C、取样,加入硝酸银有白色沉淀,一定有Cl- |
| D、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
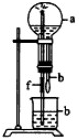
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | 水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
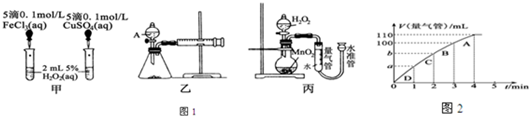
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小C的浓度 |
| B、增大B的量 |
| C、减小D的浓度 |
| D、增大A的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com